(4) Ksp=4S3 S=2.466*10-17моль/л С(Ag+)=2*C(Ag2S)=4.932*10-17моль/л m(Ag+)=C(Ag+)*V*M(Ag)=2.66*10-15 г
19 билет
Закономерности в изменении свойств атомов: радиус, энергия ионизации, энергия сродства к электрону, относительная электроотрицательность.
Необратимый гидролиз. Совместный гидролиз.
Кислород: получение, строение атома и молекулы. Аллотропия. Химические свойства. Пероксид водорода: получение, строение, свойства. Применение кислорода и пероксида водорода в медицине.
(1)Элементы расположены по своим сходным свойствам, образуя группы: главные и побочные. Энергия ионизации-min энергия, необходимая для удаления электрона из атома. В группах элементов ПСХЭ потенциалы ионизации уменьшаются с возрастанием порядкового номера (только для s- и p- элементов) Энергия, которая выделяется или поглощается при присоединении электрона к атому-энергия сродства к электрону. определяется строением электронных оболочек атомов. наиболее высокая энергия сродства характерна для галогенов. Способность атома оттягивать электр. Облако- э/о. э/о в периоде увеличивается с увеличением порядкового номера, в группах уменьшается. в группах с возраст порядкового номера возраст атомный радиус, в периоде-уменьшается. Номер элемента= заряд ядра, число электронов, число протонов; номер периода= число энерг.уровней; номер группы=число валентных электронов, max степень окисления. В периоде уменьшаются метал.св-ва, увелич.заряд ядра, уменьш.радиус, увелич.число внешних электронов. В группе увелич. Металл.св-ва, увелич заряд ядра,уменьш.радиус, число внешних электронов постоянно,с лабеет их связь с ядром.
(2) Гидролиз-обменное взаимодействие между ионами соли и водой
Особые случаи гидролиза. Необратимый гидролиз. Необратимый гидролиз известен только для некоторых солей — Cr2S3, A12S3 и др. В воде эти соли полностью разлагаются:
Cr,S3 + 6Н0Н -> 2Сг(0Н)3 + 3H2S.
К числу особых случаев гидролиза следует отнести и совместный гидролиз. Совместный гидролиз возможен в растворе двух или более солей. Условием для протекания этого типа гидролиза является гидролиз одной соли по катиону, а второй — по аниону:
А” + НОН НА + ОН", Ме+ + НОН МеОН + Н\
Образующиеся гидроксид-ионы и ионы водорода выводятся из сферы реакции в виде молекулы воды.
Этот тип — тип необратимого гидролиза. Он характерен для солей металлов со степенями окисления +3 и +2 (Fe3+, Ст3+. Си2*, Zn2+ и др.). Природа продуктов гидролиза определяется природой их солей. В случае солей металлов со степенями окисления +3 продуктами реакции является слабые основания и кислота:
CrCl3 + 3Na2C03 + 6Н20 -> 2Сг(ОН)3 + Н2С03 + 6NaCI
2А1С13 + 3Na2S + 6 Н20 = 2А1(ОН)3 + 6NaCl + 3H2S.
Если соль образована металлами со степенями окисления +2, то один из продуктов реакции — основная соль:
2CuC12 + 2Na2C03 + Н20 = (Cu0H)2C03 + СО, + 2NaCl.
(3) Кислород — самый распространенный элемент. Его массовая доля в земной коре составляет 47,4 %.. Объемная доля кислорода в земной атмосфере 21 % кислорода (массовая доля 23 %). Большое количество кислорода содержится в гидросфере (вода морей и океанов). Как простое вещество кислород существует в виде двух аллотропных модификаций: молекулярного кислорода 02 и озона Оз. Основная масса его находится в верхних слоях атмосферы (на высоте 10-30 км) и существенно влияет на климат Земли. Толщина озонного слоя всего ~3 мм. Озон задерживает губительное для живых организмов ультрафиолетовое излучение Солнца и поглощает инфракрасное излучение Земли, препятствуя ее охлаждению. Молекула 02 парамагнитна, кратность связи равна двум. Молекула Оз диамагнитна, полярна. Озон характеризуется более высокими температурами плавления и кипения, чем кислород, вследствие более сильного межмолекулярного взаимодействия. O2 получают фракционной перегонкой жидкого воздуха, электролизом воды. В лабораторной практике кислород получают термическим разложением солей или оксидов: 2КС10з = 2КС1 + 302 (катализатор Мп02) 2КМ11О4 = К2Мп04 + Мп02 + 02 2KN03 = 2KN02 + 02 Озон получают действием тихого электрического разряда на кислород в специальных приборах — озонаторах:302 203 Озон— эндотермическое соединение но разлагается довольно медленно. Пероксид водорода получают гидролизом пероксидисерной кислоты или ее солей: H2S208 + 2Н20 = 2H2S04 + Н202 и окислением алкилантрацен-9,10-диолов, пропан-2-ола и других веществ. По данным рентгеноструктурного анализа молекула Н202 имеет несимметричное строение: температура кипения Н2О2 выше, чем температура кипения воды, и составляет 150 °С. В обычных условиях Н2О2 — сиропообразная жидкость, с водой смешивается в любых соотношениях. В растворе пероксид водорода проявляет слабо выраженные кислотные свойства, реагирует с основаниями: Н202 + 2LiOH = Li202 + 2Н20 Степень окисления кислорода в Н2О2 равна -I, поэтому пероксид водорода проявляет окислительно-восстановительную двойственность. Вследствие меньшей прочности связи 0-0 для Н2О2 более характерны окислительные свойства: Н202 + 2Ш = 12 + 2Н20 Восстановительные свойства Н2О2 проявляет только при взаимодействии с сильными окислителями: Н2О2 + Ag20 = 2Ag + О2 + Н2О При хранении пероксид водорода постепенно разлагается: 2Н202 = 2Н20 + 02 Процесс разложения ускоряется под действием света, при нагревании и в присутствии катализаторов (Pt, М11О2, NaOH). В фармацевтической практике применяются 3%-ный раствор Н2О2 и 30%-ный (пергидроль). Окислительные свойства Н2О2 проявляет в реакции с хлоридом хрома(Ш) в щелочной среде: СгС13 + 4NaOH = Na[Cr(OH)4] + 3NaCl 2Na[Cr(OH)4] + ЗН2О2 + 2NaOH = 2Na2Cr04 + 8H20. а восстановительные — с перманганатом калия: 2KMn04 + 3H2S04 + 5Н202 = 2MnS04 + 502 + K2S04 + 8Н20
(4) m=C*V*M=4.8 г V=m/(C(1/z)*M(1/z))=1л
Билет
Растворы слабых электролитов. Константа ионизации. Ступенчатый характер ионизации. Смещение ионных равновесий в растворах слабых кислот и оснований.
Закон действующих масс. Константа химического равновесия и ее связь со стандартным изменением энергии Гиббса. Общая характеристика p-элементов IV группы, строение атомов. Строение и свойства простых веществ и соединений с серой, галогенами, кислородом.
(1) Вещества, распадающиеся в растворах или расплавах на ионы, называют электролитами, а процесс распада молекул на положительно и отрицательно заряженные ионы под действием растворителя называется электролитической диссоциацией.


 Слабые электролиты – вещества, молекулы которых в растворах ионизированы со степенью ионизации α < 3%. К ним относятся слабые кислоты и слабые основания.
Слабые электролиты – вещества, молекулы которых в растворах ионизированы со степенью ионизации α < 3%. К ним относятся слабые кислоты и слабые основания.
Процесс ионизации обратим:
Константа ионизации показывает отношение частиц, диссоциирующих в раствор, к количеству непродиссоциировавшего вещества.
Ионизация слабого электролита — процесс равновесный:СН3СООН <± Н+ + СН3СОСГ. В отличие от солей среди кислот и оснований есть и сильные и слабые электролиты. Большинство кислот и оснований — слабые электролиты. Ka и Kb зависят от природы, температуры, но не зависят от концентрации вещества.Ионизация электролитов, основность иили кислотность которых более 1 происходит ступенчато:
Диссоциация по каждой последующей ступени происходит в меньшей степени, чем по предыдущей. 
(2) Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции. Для обратимой реакции, записанной в общем виде аА + bB ↔ dD + eE константа химического равновесия, выраженная через молярные концентрации, запишется следующим образом: 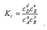 Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (ΔGT) может быть рассчитана по уравнению: Энергия Гиббса зависит от:
Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (ΔGT) может быть рассчитана по уравнению: Энергия Гиббса зависит от:
энтальпийного фактора: стремление частиц образовывать сложные связи для понижения П(потенциальной энергии)
энтропийного фактора: при повышении температуры частицы стремятся разорвать связи Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции: 
ΔG<0 – процесс протекает самопроизвольно
ΔG=0 – процесс равновесный
ΔG>0 – процесс не протекает самопроизвольно
( 3) p-Элементы группы IV образуют неорганические соединения со степенями окисления -IV; 0; II; IV. Для углерода, кремния, германия и олова устойчивой является степень окисления IV, а для свинца — степень окисления II. Это связано с тем, что 6s- электроны атомов свинца, как и таллия, экранированы 4f- и 5d-электронными оболочками и являются инертными, т. е. мало склонны к образованию связей. Энергия ионизации и ОЭО атомов уменьшаются от углерода к свинцу, что свидетельствует об уменьшении неметаллических и увеличении металлических свойств. Углерод и кремний являются типичными неметаллами, свинец — металл, а германий и олово проявляют промежуточные свойства. Особенностью химии углерода является способность его атомов к образованию кратных связей и гомоцепей —С—С—С—С— с большим числом атомов. Атомы кремния также способны соединяться друг с другом в цепи, но, в отличие от соединений углерода, длина их составляет не более 6-8 атомов. Особенностью химии кремния является чрезвычайно высокая прочность связи Si—О, что объясняет стремление соединений кремния (гидридов, галогенидов и др.) превращаться в кислородосодержащие соединения. В образовании химических связей участвуют орбитали только внешнего энергетического уровня. Особенностью строения атома углерода, как элемента второго периода, является наличие на предпоследнем уровне только двух электронов (оболочка гелия) и отсутствие -орбиталей во внешнем (валентном) электронном слое. С серой дисульфид водорода(СS2), при комнатной температуре разлагается водой. С галогенами хлороформ, йодоформ (СH3Cl,CH3I). СS2+ 3Cl2=CCl4+S2Cl2. У кремния галогениды при взаимодействии с Г2. SiO2+2C+2Г2=SiГ4+2СO. Галогениды – летучие соединения. С кислородом у кремния SiO2, у С – СО, СО2, С3О2.
(4) Ksp=4S3 S=10-4моль/л S(Ag+)=2*10-4моль/л S(Ag+)=216*10-4г/л
21билет
Химические равновесия в растворах электролитов. Константы равновесия в гомо- и гетерогенных системах. Смещение химических равновесий в растворах электролитов. Ионизация комплексных соединений в растворах. Константа нестойкости. Разрушение комплексных соединений. Общая характеристика d-элементов VII группы. Строение атомов. Химическая активность. Основные соединения
(1) Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций Любое изменение условий химического равновесия (Т, р, с) приводит к изменению положения равновесия. Направление смещения равновесия определяется принципом Ле Шателье: Любое изменение одного из условий химического равновесия (температуры, давления, концентрации) приводит к смещению равновесия в направлении реакции, протекание которой уменьшает эффект произведенного изменения. 1) Влияние температуры. Повышение температуры смещает положение равновесия в сторону эндотермической реакции, а понижение – в сторону экзотермического процесса. 2) Влияние давления. Давление влияет на положение равновесия реакций, протекающих с участием газообразных веществ. Увеличение давления смещает положение равновесия реакции в сторону уменьшения числа моль газообразных веществ, т.е. в сторону уменьшения давления. При уменьшении давления равновесие смешается в сторону увеличения числа моль газообразных веществ, т.е. в сторону увеличения давления. 3) Влияние концентрации. Увеличение концентрации одного из реагирующих веществ смещает равновесие в сторону реакции, ведущей к его связыванию и наоборот, уменьшение концентрации вещества смещает равновесие в сторону процесса образования этого соединения. Состояние химического равновесия устойчиво и может сохраняться неограниченно долго при постоянных внешних условиях. В состоянии химического равновесия прямая и обратная реакции протекают с равными скоростями, химическое равновесие является динамическим равновесием. Отношение констант скоростей прямой и обратной реакций является также величиной постоянной и носит название константы химического равновесия. Величина константы химического равновесия зависит только от природы реагирующих веществ и температуры. Катализатор не влияет на величину константы химического равновесия. Для обратимой реакции, записанной в общем виде аА + bB ↔ dD + eE константа химического равновесия, выраженная через молярные концентрации, запишется следующим образом: 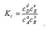 Константа равновесия гетерогенных реакций не включает концентрации твердых веществ.
Константа равновесия гетерогенных реакций не включает концентрации твердых веществ.
(2) Комплексообразование-ступенчатый процесс, каждая ступень характеризуется константй равновесия, которая называется константой образования комплекса, часто используется термин константа устойчивости.
Пример: растворе содержащем ионы Hg2+ и Br- имеют место следующие равнтвесия:
Hg2+ +Br-<=> HgBr + ;K1=[ HgBr + ]/[ Hg2+]*[ Br –]
HgBr+ + Br-<=> HgBr2 ;K2=[ HgBr2]/[ HgBr + ]*[ Br -]
HgBr2 + Br-<=> HgBr3- ;K3=[ HgBr3-]/[ HgBr2]*[ Br -]
HgBr3- + Br-<=> HgBr42- ;K4=[ HgBr42-]/[ HgBr3-]*[ Br -]
K1, K2, K3, K4, - ступенчатые константы образования
Общая константа образования Кn = K1* K2* K3* K4=[ HgBr42-]/[Hg2+][Br -]4
При растворении в воде комплексных соединений, содержащий комплексные катиоы или комплексные анионы, происходит ионизация по типу сильных электролитов:
K2[HgBr4] 2K+ + HgBr42-
Ионизация комплексного иона идет по типу слабого электролита, ступенчато и обратимо:
HgBr42- HgBr3-+Br - K4H=[ HgBr3- ]*[ Br -]/ [HgBr42-]
HgBr3- HgBr2 + Br -K3H=[ HgBr2]*[ Br -]/[HgBr3-]
HgBr2 HgBr + + Br -K2H =[ HgBr +]*]*[ Br -]/[ HgBr2]
HgBr + Hg2+ + Br -K1H =[ Hg2+]*[ Br -]/[ HgBr +]
K1H, K2H, K3H, K4H называется константами нестойкости. Общая константа нестойкости равна произведению ступенчатых:
K H= K1H* K2H * K3H * K4H =[ Hg2+]*[ Br -]4/[ HgBr42- ]
Гипотетическое равновесие [HgBr42- ] Hg2+ +4 Br –
Константа образования обратная величина константы нестойкости Кn=1/ K H
Эти константы характеризуют устойчивость комплексных частиц: чем больше константа образования, тем более устойчива частица.
[Ag(NH3)2]Cl
+2HNO3=AgCl+2NH4NO3
2[Ag(NH3)2]Cl+
2H2S=Ag2S+2NH4Cl+(NH4)2S
Разрушение может происходить в процессе окислительно-восстановительной реакции.
Fe(CO)5+2HCl=FeCl2+5CO+H2
(3)При переходе от от марганца к рению уменьшается устойчивость низших степеней окисления и возрастает устойчивость высших степеней окисления, как и в ряду d- элементов группы VI. Так, для марганца наиболее устойчива степень окисления +IV, а для технеция и рения — +VII. Кислородом марганец окисляется до Мп02, а технеций и рений — до Э207.
Марганец способен вытеснять водород из кислот, а при нагревании — разлагать воду: Мп + 2Н20 = Мп(ОН)2 + Н2|
Для технеция и рения образование катионных соединений не характе, эти металлы малоактивны и с разбавленными кислотами не взаимодействуют. Концентрированная азотная кислота окисляет их до технециевой и рениевой кислот: Э+7HN03=НЭ04+7N02 + 3H20 В этих же условиях марганец реагирует как металл, образуя соль марганца(П):Мп+4HN03= Mn(N03)2+2N02+2Н20. Кислотно-основные свойства гидроксидов зависят от степени окисления марганца. С возрастанием степени окисления увеличивается ковалентность связи Мп-О, поэтому усиливается ионизация гидроксидов по кислотному типу и уменьшается по основному. Так, Мп(ОН)2 — слабое основание, Мп(ОН)4 — амфолит, НМп04 — сильная кислота. В ряду Мп(ОН)2, Мп(ОН)3, Мп(ОН)4, (Н2Мп04), НМп04 усиливаются кислотные свойства, а основные ослабевают.
(4) Ksp(AgCl)=S2 S=0,134*10-4 Ksp(Ag2CrO4)=4S3 S=0.734*10-4 S(Ag2CrO4)> S(AgCl) в 5,5 раз
22 билет
Связь в комплексных соединениях по методу ВС. Геометрия комплексных ионов. Магнитные свойства.
Отношение металлов к растворам кислот и щелочей.
Серебро, золото: строение атомов, свойства. Оксиды, гидроксиды, соли, комплексные соединения.
(1) В основе метода валентных связей лежат представления о двухэлектронной двухцентровой химической связи и гибридизации орбиталей центрального атома, определяющей геометрическую конфигурацию иона. В применении к комплексным соединениям центральный атом — это атом или ион комплексообразователя, обладающий вакантными орбиталями. Необходимая для образования связи пара электронов поставляется лигандом. Таким образом, реализуется донорно-акцепторный механизм образования химической связи. Акцептор — ион или атом комплексообразователя, донор-лиганд. Возникающая при этом химическая связь считается чисто ковалентной. Для определения геометрической конфигурациии комплексного иона необходимо определить тип гибридизации орбиталей центрального атома, принимающих участие в образовании химической связи. В отличие от p-орбиталей не все d-орбитали могут принимать участие в гибридизации. В гибридизации участвуют только d z2- и dxг_уг -орбитали, т. е. орбитали, для которых области максимальной электронной плотности ориентированы вдоль координатных осей, как и в случае />орбиталей. Орбитали dxy., dxz и dyz участия в гибридизации принимать не могут. Для случая октаэдрической конфигурации комплексных ионов возможные типы гибридизации cfsp3 или sp3cf, в зависимости от того, участвуют в гибридизации d - орбитали предвнешнего или внешнего слоя.
Возможны и другие типы гибридизации. К примеру при гибридизации орбиталей dx2_yi, s, рх, ру — тип гибридизации dsp2, а геометрическая конфигурация комплексного иона — плоский квадрат. ^/-Электроны иона металла располагаются на орбиталях dxy., dyz, dxz- Вопрос о типе гибридизации в каждом конкретном случае определяется природой лиганда. В частности для комплексного иона [Со(NH3)6]3+ характерна d2sp3- гибридизация (I), а для иона [CoFe]3- — sp3d2 -гибридизация (II). Комплексы типа (I) называют внутриорбитальными, а типа (II) — внешнеорбитальными. Метод ВС не может предсказывать, но объясняет магнитные свойства комплексных соединений. Рассмотренные выше примеры показывают, что ион [Со(NH3)6]3+ должен быть диамагнитен, a [CoFe]3 — парамагнитен. Количественные характеристики магнитных свойств методом ВС не объясняются. В определенной мере метод ВС может прогнозировать и реакционную способность комплексных ионов. В частности замещение лигандов внешнеорбитальных комплексов протекает легче в сравнении с замещением лигандов внутриорбитальных комплексов. Геометрическая изомерия. Она является следствием различного расположения лигандов во внутренней сфере координационного соединения. Этот вид изомерии изучен в основном на соединениях с координационными числами 6 и 4, имеющими форму октаэдра и квадрата, соответственно. Изомеры, в которых два одинаковых лиганда расположены на одном ребре квадрата или октаэдра, называются цис- изомерами (от лат. cis — вместе). Соединения, в молекулах которых два одинаковых лиганда расположены по диагонали, называют даранс-изомерами (от лат. trans — напротив).
(2) С водными растворами щелочей взаимодействуют металлы, расположенные в ряду напряжений до водорода и образующие амфотерные гидроксиды: Be, Al, Zn, Cr, Sn, Pb. Взаимодействие часто обусловлено сдвигом величины электродного потенциала металла в сторону отрицательных значений за счет процесса образования гидроксокомплексов. В качестве примера рассмотрим реакцию: Zn + 2H2O + 2NaOH = Na2[Zn(OH)4] + H2, Ее можно представить в виде двух более простых: Zn + 2H2O = Zn(OH)2 + H2; растворение образующегося амфотерного гидроксида в избытке щелочи с образованием гидроксокомплекса: Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]. Металлы, стоящие в ряду напряжений до водорода, должны вытеснять его из растворов этих кислот. Некоторые малоактивные металлы, не взаимодействующие с разбавленными растворами кислот - слабых окислителей, взаимодействуют с концентрированными растворами этих же кислот. В частности, медь не взаимодействует с разбавленными растворами соляной кислоты, но растворяется в ее концентрированных растворах за счет процесса комплексообразования: 2Cu + 4HCl = 2H[CuCl2] + H2 Окислителем в концентрированных растворах H2SO4 является S в ионах HSO4-, SO42-. В зависимости от активности металла он может восстанавливаться до H2S, S или до SO2 4Mg + 5H2SO4(к) = 4MgSO4 + H2S + 4H2O 3Zn + 4H2SO4(к) = 3ZnSO4 + S + 4H2O Cu + 2H2SO4(к) = CuSO4 + SO2 + 2H2O
| Концентрация HNO3 | Продукты восстановления азотной кислотой | |
| Ме активые | Ме малоактив | |
| Конц.(>60%) | NO2 | NO2 |
| Средн. конц.(25-30%) | NO | NO |
| Разб.(10-15%) | N2O, N2 | Не реагирует |
| Очень разб.(<5%) | NH4NO3, NH3 | Не реагирует |
Пассивируются в концентрированных растворах HNO3 (на холоду) Be, Al, Cr, Fe, Co, Ni, Ti, Zr, Hf, Pb, Bi но при нагревании ряд металлов начинает активно взаимодействовать с HNO3. Не взаимодействуют: Pt, Au, Ir, Ru, Rh, Nb, Ta. Ряд малоактивных металлов (Au, Ru, Os) не растворяется (или очень плохо) в перечисленных выше кислотах - сильных окислителях. Однако, в смесях кислот, в частности, HNO3 + 3HCl (“царская водка”) эти металлы растворяются: Au + HNO3 + 4HCl = H[AuCl4] + NO2 + 2H2O (3) серебро и золото являются хорошими комплексообразователями. В присутствии лигандов восстановительная активность этих металлов возрастает. Золото и серебро окисляются кислородом только в присутствии цианид-ионов (из-за образования устойчивых комплексов) или сероводорода (вследствие образования малорастворимых сульфидов): 4Au + 02 + 8KCN + 2Н20 = 4K[Au(CN)2] + 4КОН 4Ag + 02 + 2H2S = 2Ag2S + 2Н20 Медь и серебро при нагревании реагируют с серой с образованием 32S. С хлором эти металлы образуют соответственно CuCl2, AgCl и A11CI3. серебро растворяtтся в азотной и концентрированной серной кислотах:Ag + 2HN03 = AgN03 + N02 + Н20 Ag + 2H2S04 = Ag2S04 + S02 + 2H20 Золото можно растворить в концентрированной селеновой кислоте и в «царской водке»:2Au + 6H2Se04 = Au2(Se04)3 + 3Se02 + 6H20 Au + HNO3 + 4HC1 = H[AuC14] + NO + 2H20 Гидроксид серебра(1) очень неустойчив и в водном растворе не образуется: 2AgN03 + 2NaOH = Ag20 + 2NaN03 + H20 AgOH может быть получен при действии щелочи на спиртовый раствор нитрата серебра при -50 °С. Гидроксиды золота(1) и (III) получают обменными реакциями. Амфотерный Аи(ОН)з — золотая кислота — растворяется в кислотах и щелочах с образованием комплексных соединений: Au(OH)3 + NaOH = Na[Au(OH)4] Au(OH)3 + 4НС1 = H[AuC14] + 3H20 Галогениды серебра можно получить действием галогенов на серебро. Растворимость AgHlg уменьшается в ряду AgF - Agl. Фторид серебра хорошо растворим в воде. Остальные галогениды серебра малорастворимы (и могут быть получены обменными реакциями в растворе: Ag+ + Hlg- = AgHlg Эта реакция используется для качественного и количественного определения галогенид-ионов в растворе. AgCl и AgBr растворяются в концентрированном аммиаке с образованием комплексного иона [Ag(NH3)2]+. Agl в аммиаке не растворяется. Все галогениды серебра растворяются в растворе тиосульфата натрия: AgHlg + 2S20r = [Ag(S203)2]3- + Hlg Галогениды серебра обладают светочувствительностью, и это свойство используют в фотографии. Содержащийся в фотопленке AgBr при экспонировании и проявлении разлагается: 2AgBr = 2Ag + Br2 (4) α=sqrt(Ka/Cm) Ka=1.76*10-4 C=C(1/z)/z=0.01M C[H+]=sqrt(Ka*Cm) = 0,0042 pH=-lgC[H+]= 2,377
23Билет Ионное произведение воды. Водородный показатель. Индикаторы. Буферные растворы.Классификация и номенклатура комплексных соединений. Биологическая роль комплексных соединений. Общая характеристика элементов III группы. Строение атомов, деление на подгруппы. Химические свойства бора.
(1)Вода – слабый электролит. Ее ионизация происходит в соответствии с уравнением Н2О+Н2О=Н3О++ОН- К=(С(Н+)*С(ОН-))/С(Н2О)=1,8*10-16. С(Н2О)=m(Н2О)/М(Н2О)V(Н2О)=1000/18*1=55,55 моль/л. Подставив это значение в уравнение, получим: 1,8*10-16*55,55=С(Н+)*С(ОН-) или С(Н+)*С(ОН-)=10-14. Произведение С(Н+)*С(ОН-) называется ионным произведением воды и обозначается Кw. Уравнение используется для вычисления концентраций С(Н+) и С(ОН-) в водных растворах. В растворах с ионной силой I>0.001 используют активности ионов водорода и гидроксид-иона. В этом случае Kw=а(Н+)*а(ОН-).рН=-lgС(Н+), рОН=-lgС(ОН-) – для слабых электролитов; рН=-lgа(Н+), рОН=-lgа(ОН-) – для сильных электролитов. Растворы слабой кислоты и ее соли или слабого основания и его соли называются буферными. Они обладают двумя важными свойствами, которые и определяют их широкое применение: 1) Буферные растворы поддерживают постоянное значение рН при добавлении к ним небольших количеств кислот и оснований. 2) Буферные растворы сохраняют постоянное значение рН при разбавлении.