(1) Основные положения МВС применительно координационных соединений.
Связь двухэлектронная.
Двухцентровая.
Локализованная.
Связь между комлексообразователем и лигандом осуществляется по донорно-акцепторному механизму. Лиганды – доноры, комплексообразователи – акцепторы.
Орбитали центрального атома, участвующие в образовании ϭ-связей, гибридизуются. Тип гибридизации определяется числом, природой и эл. структурой лигандов.
Наряду с ϭ-связями могут образовываться π-связи. Это происходит, если занятая электронами орбиталь комплексообразователя будет перекрываться с вакантными орбиталями лиганда. Комплексообразователь – донор, лиганд – акцептор.
В случае ϭ-связи перенос эл. плотности происходит от лиганда на комплексообразователь, а в случае π-связи – наоборот.
Магнитные свойства, проявляемые комплексом, объясняются исходя из заселенности орбиталей: есть неспаренные электроны – парамагнитный комплекс; если все электроны спарены – диамагнитный комплекс.
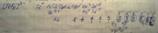
Ион октаэдрический, парамагнитный, высокоспиновой, внешнеорбитальный.

Ион октаэдрический, низкоспиновой, внутриорбитальный, диамагнитный.
(2) С водными растворами щелочей взаимодействуют металлы, расположенные в ряду напряжений до водорода и образующие амфотерные гидроксиды: Be, Al, Zn, Cr, Sn, Pb. Взаимодействие часто обусловлено сдвигом величины электродного потенциала металла в сторону отрицательных значений за счет процесса образования гидроксокомплексов. В качестве примера рассмотрим реакцию: Zn + 2H2O + 2NaOH = Na2[Zn(OH)4] + H2, Ее можно представить в виде двух более простых: Zn + 2H2O = Zn(OH)2 + H2; растворение образующегося амфотерного гидроксида в избытке щелочи с образованием гидроксокомплекса: Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]. Металлы, стоящие в ряду напряжений до водорода, должны вытеснять его из растворов этих кислот. Некоторые малоактивные металлы, не взаимодействующие с разбавленными растворами кислот - слабых окислителей, взаимодействуют с концентрированными растворами этих же кислот. В частности, медь не взаимодействует с разбавленными растворами соляной кислоты, но растворяется в ее концентрированных растворах за счет процесса комплексообразования: 2Cu + 4HCl = 2H[CuCl2] + H2 Окислителем в концентрированных растворах H2SO4 является S в ионах HSO4-, SO42-. В зависимости от активности металла он может восстанавливаться до H2S, S или до SO2 4Mg + 5H2SO4(к) = 4MgSO4 + H2S + 4H2O 3Zn + 4H2SO4(к) = 3ZnSO4 + S + 4H2O Cu + 2H2SO4(к) = CuSO4 + SO2 + 2H2O
| Концентрация HNO3 | Продукты восстановления азотной кислотой | |
| Ме активые | Ме малоактив | |
| Конц.(>60%) | NO2 | NO2 |
| Средн. конц.(25-30%) | NO | NO |
| Разб.(10-15%) | N2O, N2 | Не реагирует |
| Очень разб.(<5%) | NH4NO3, NH3 | Не реагирует |
Пассивируются в концентрированных растворах HNO3 (на холоду) Be, Al, Cr, Fe, Co, Ni, Ti, Zr, Hf, Pb, Bi но при нагревании ряд металлов начинает активно взаимодействовать с HNO3. Не взаимодействуют: Pt, Au, Ir, Ru, Rh, Nb, Ta. Ряд малоактивных металлов (Au, Ru, Os) не растворяется (или очень плохо) в перечисленных выше кислотах - сильных окислителях. Однако, в смесях кислот, в частности, HNO3 + 3HCl (“царская водка”) эти металлы растворяются: Au + HNO3 + 4HCl = H[AuCl4] + NO2 + 2H2O
(3) серебро и золото являются хорошими комплексообразователями. В присутствии лигандов восстановительная активность этих металлов возрастает. Золото и серебро окисляются кислородом только в присутствии цианид-ионов (из-за образования устойчивых комплексов) или сероводорода (вследствие образования малорастворимых сульфидов): 4Au + 02 + 8KCN + 2Н20 = 4K[Au(CN)2] + 4КОН 4Ag + 02 + 2H2S = 2Ag2S + 2Н20 Медь и серебро при нагревании реагируют с серой с образованием 32S. С хлором эти металлы образуют соответственно CuCl2, AgCl и A11CI3. серебро растворяtтся в азотной и концентрированной серной кислотах:Ag + 2HN03 = AgN03 + N02 + Н20 Ag + 2H2S04 = Ag2S04 + S02 + 2H20 Золото можно растворить в концентрированной селеновой кислоте и в «царской водке»:2Au + 6H2Se04 = Au2(Se04)3 + 3Se02 + 6H20 Au + HNO3 + 4HC1 = H[AuC14] + NO + 2H20 Гидроксид серебра(1) очень неустойчив и в водном растворе не образуется: 2AgN03 + 2NaOH = Ag20 + 2NaN03 + H20 AgOH может быть получен при действии щелочи на спиртовый раствор нитрата серебра при -50 °С. Гидроксиды золота(1) и (III) получают обменными реакциями. Амфотерный Аи(ОН)з — золотая кислота — растворяется в кислотах и щелочах с образованием комплексных соединений: Au(OH)3 + NaOH = Na[Au(OH)4] Au(OH)3 + 4НС1 = H[AuC14] + 3H20 Галогениды серебра можно получить действием галогенов на серебро. Растворимость AgHlg уменьшается в ряду AgF - Agl. Фторид серебра хорошо растворим в воде. Остальные галогениды серебра малорастворимы (и могут быть получены обменными реакциями в растворе: Ag+ + Hlg- = AgHlg Эта реакция используется для качественного и количественного определения галогенид-ионов в растворе. AgCl и AgBr растворяются в концентрированном аммиаке с образованием комплексного иона [Ag(NH3)2]+. Agl в аммиаке не растворяется. Все галогениды серебра растворяются в растворе тиосульфата натрия: AgHlg + 2S20r = [Ag(S203)2]3- + Hlg Галогениды и проявлении разлагается: 2AgBr = 2Ag + Br2
(4) α=sqrt(Ka/Cm) Ka=1.76*10-4 C=C(1/z)/z=0.01M C[H+]=sqrt(Ka*Cm) = 0,0042 pH=-lgC[H+]= 2,377