Лекция 2
ЭЛЕМЕНТЫКИНЕТИЧЕСКОЙ ТЕОРИИ
И ГАЗОВЫЕ ЗАКОНЫ
ЗАКОНЫИДЕАЛЬНЫХ ГАЗОВ
Разреженные газы по своим свойствам близки к идеальным, поэтому найденные опытным путем законы поведения разреженных газов используются для описания идеальных газов.
Закон Бойля – Мариотта
При постоянной массе газа Nm и температуре Т произведение давления газа р на на его объем V есть величина постоянная:
pV = const (1.5)
Или Vуд = 1/r — удельный объем; r – плотность газа.
pVуд = const (1.6)
Сравнивая (1.6) и (1.4), видим, что при постоянной температуре скорость теплового движения молекул газа остается неизменной. При одной и той же температуре средняя кинетическая энергия молекул одинакова для всех газов.
При решении многих задач вакуумной техники бывает удобно количество газа выражать именно в единицах pV, т. е. в м3 × Па = Н × м.
Закон Авогадро
N = N1V, т.е. сколько частиц находиться именно в этом объеме
Умножив обе части уравнения (1.2) на V, получим:
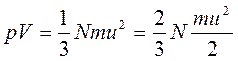 (1.8)
(1.8)
mu2/2 ~ T
Т.е. при равных температурах и давлениях равные объемы различных газов V содержат одинаковое количество молекул N.
Молекулярная масса М любого газа или пара определяется как выраженная в килограммах масса такого количества газа, которое при 273 К и давлении 1,02×105 Па занимает объем 22,41 м3.
Один моль газа содержит NА = 6,0228×1023 молекул. NA называется числом Авогадро.
Число молекул, содержащихся в 1 см3 при 273 К и 1,02×105 Па, называется числом Лошмидта: NЛ = 2,687×1019 молекул/см3.
Закон Гей-Люссака
При постоянной массе Nm и давлении р объем газа пропорционален его абсолютной температуре:
V = const T (1.9)
Закон Шарля
При постоянной массе Nm и объеме V давление газа пропорционально его абсолютной температуре:
P = const T (1.10)
Закон Дальтона
Полное давление смеси химически не взаимодействующих газов равно сумме парциальных давлений отдельных газов.
Парциальным давлением газа, входящего в смесь, называется давление, которое этот газ имел бы, если бы в объеме, занимаемом смесью, был только он один.
рcмVcм = р1Vсм + р2Vсм + ••• + рпVсм (1.11)
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
Уравнение состояния идеальных газов является результатом обобщения законов идеальных газов и записывается следующим образом:
pV = kTN (1.12)
где k – коэффициент пропорциональности, называемый постоянной
Больцмана (k = 1,38×10-23 Дж/К);
Т – абсолютная температура газа (К(!!!)); N– число молекул.
Для одного киломоля газа уравнение (1.12) примет вид:
PV0 = k×T×NA = R0T (1.13)
Где R0 = k×NA – универсальная газовая постоянная, одинаковая для всех
газов, R0 = 1,986 кал/(К×кмоль) = 8,314×103 Дж/(К×кмоль);
NA – число Авогадро; V0 – объем одного киломоля газа.
В общем виде уравнение (1.13) записывается следующим образом:
pV = nMR0T (1.14)
где nM = N/NA – число киломолей газа в объеме V.
Приравнивая правые части уравнений (1.8) и (1.14)
pV = nMR0T и 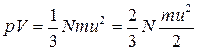
и решая относительно и, получаем:
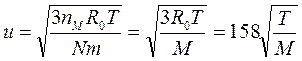
где M = NA×m – молекулярная масса газа.
Таким образом, средняя квадратичная скорость теплового движения молекул газа прямо пропорциональна квадратному корню из абсолютной температуры и обратно пропорциональна квадратному корню из молекулярной массы газа.
Сопоставление уравнений (1.8) и (1.12) приводит к соотношению:
(pV = kTN и 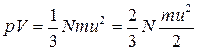 )
)
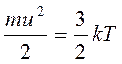 (1.16)
(1.16)
При одинаковой температуре средняя кинетическая энергия теплового движения молекул любого газа одинакова и равна 3/2 kТ.
Задачи
