Введение
Свинец — редкий минерал, самородный металл класса самородных элементов. Ковкий, сравнительно легкоплавкий металл серебристо-белого цвета с синеватым отливом. Известен с глубокой древности. Очень пластичный, мягкий (режется ножом, царапается ногтем). При ядерных реакциях образуются многочисленные радиоактивные изотопы свинца.
Общие данные
Свинец – элемент 14-й группы (по устаревшей классификации — главной подгруппы IV группы), шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Простое вещество свинец — ковкий, сравнительно легкоплавкий тяжёлый металл серебристо-белого цвета с синеватым отливом. Плотность свинца — 11,35 г/см³. Свинец токсичен. Известен с глубокой древности.
Свинец имеет довольно низкую теплопроводность. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет. С повышением температуры плотность свинца падает.
Электроотрицательность
Электроотрицательность свинца по шкале Полинга равна 1,9 и очень мало отличается от значения электроотрицательности кремния, германия и олова (1,8).
Однако, ковалентный радиус свинца больше, чем у остальных элементов IV Б подгруппы. Соответственно, больше длѝны связей с атомами других элементов и, как следствие этого, выше поляризуемость этих связей и стерическая доступность атома свинца, окруженного четырьмя заместителями. Это приводит к пониженной термической и фотоустойчивости соединений свинца, а также к их более высокой реакционной способности.
Нахождение в природе
Образует вкрапленность в изверженных, главным образом кислых, горных породах. Встречается в россыпях с самородными Au, Pt, Os, Ir.
В природных условиях часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы. Единственное место на земле, где в породах больше свинца по сравнению с ураном — Кохистанско-Ладакхская дуга на севере Пакистана.
Содержание в земной коре — 1,6·10−3 % по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В этих образованиях он часто образует интерметаллические соединения (например, звягинцевит (Pd,Pt)3(Pb,Sn) и др.) и сплавы с другими элементами (например, (Pb + Sn + Sb)). Он входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4 (сульфат свинца); из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория, имея часто радиогенную природу.
Основные классы свинецорганических соединений
Важнейшие классы свинецорганических соединений:
1. R4Pb
Тетраорганопроизводные свинца (тетраорганоплюмбаны)
2. RnPbHal4-n
Органогалогенпроизводные свинца (ограногалогенплюмбаны)
3. Pb-O-C
Соединения свинца с эфирными связями органоалкокси(арокси)плюмбаны
В литературе встречаются названия как свинецорганических соединений как производных плюмбана а также по номенклатуре для металорганических соединений, когда в названии используется слово свинец. Обе номенклатуры используются практически в равной степени.
Способы получения
Первое свинецорганическое соединение – гексаэтилдисвинец – было получено в 1853 году реакцией сплава Pb-Na с этилиодидом:
Pb-Na + C2H5I  (C2H5)3Pb-Pb(C2H5)3
(C2H5)3Pb-Pb(C2H5)3
Этот способ получения свинецорганических соединений сохранил свое значение и в настоящее время.
За последнее время свинецорганические соединения получили широкое практическое применение. Особенно важны тетраалкилпроизводные свинца из-за их высоких антидетонационных свойств. При нагревании они распадаются, давая металлический Pb и свободные радикалы. На этом свойстве основано применение Pb(C2H5)4 в качестве антидетонационной добавки к моторному топливу.
Свинецорганические соединения могут быть получены с помощью реактиваГриньяра и хлорида свинца.
Ø Для синтеза тетраалкилпроизводных свинца возможны несколько методов.
1. Реакция хлористого или бромистого алкила со свинцово-натриевым сплавом:
4 RHal + 4 PbNa  PbH4 + 3 Pb + 4 NaHal
PbH4 + 3 Pb + 4 NaHal
2. Через магнийорганический синтез – взаимодействие алкил-магнийгалогенида с хлористым свинцом:
10 MgBr + 5 PbCl2  PbR4 + PbR6 + 2 Pb + 10 MgBrCl
PbR4 + PbR6 + 2 Pb + 10 MgBrCl
Выход тетраалкилсвинца зависит от условий реакции. Так, при температуре ниже 20 оС до 40% увеличивается выход гексаалкилдисвинца Pb2R6; наоборот, при температуре выше 20 оС, гексаалкилдисвинец разлагается.
2 Pb2R6  3 PbR4 + Pb
3 PbR4 + Pb
и, соответственно, выход тетраалкилсвинца увеличивается.
3. Алкилирование безводного диацетата свинца триалкилалюминием:
6 Pb (OCOCH3)2 + 4 R3Al  3 PbR4 + 3 Pb + 4 Al (OCOCH3)3
3 PbR4 + 3 Pb + 4 Al (OCOCH3)3
4. Электролиз водно-спиртового раствора бромистого или иодистого алкила и едкого натра (катодная жидкость). В качестве материала для катода можно применить губчатый свинец, для анода – графит. Механизм процесса, вероятно, таков:
4 RHal  4 R* + 2 Hal2
4 R* + 2 Hal2
Pb + 4 R*  PbR4 (на катоде)
PbR4 (на катоде)
Hal2 + 2 NaOH  NaHal + NaOHal + H2O (на аноде)
NaHal + NaOHal + H2O (на аноде)
Образовавшийся тетраалкилсвинец отделяют при перегонке с водяным паром.
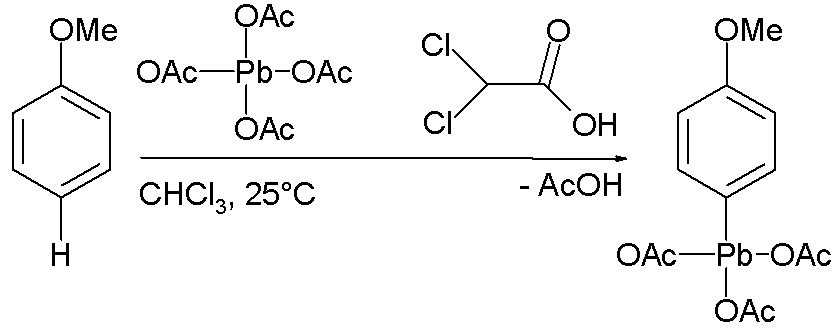
Ø Некоторые ароматические соединения могут реагировать непосредственно с тетраацетатом свинца, образуя ароматические соединения свинца по механизму электрофильного ароматического замещения. К примеру, анизол при взаимодействии с тетраацетатом свинца образует пи-метоксифенил в хлороформе и дихлоруксусной кислоте:
Ø Другие соединения свинца — свинецорганические галогениды типа RnPbX(4-n), свинецорганические сульфинаты (RnPb(OSOR)(4−n)) и свинецорганические гидроксиды (RnPb(OH)(4−n)). Типичные реакции:
R4Pb + HCl → R3PbCl + RH
R4Pb + SO2 → R3PbO(SO)R
R3PbCl + 1/2Ag2O (aq) → R3PbOH + AgCl
R2PbCl2 + 2 OH− → R2Pb(OH)2 + 2 Cl−
Соединения типа R2Pb(OH)2 амфотерны. При pH ниже 8 они образуют ионы R2Pb2+, а при pH выше 10 — ионы R2Pb(OH)3-.
Важное практическое значение имеет и электролиз комплексных металорганических соединений на свинцовом аноде. Так, Циглером был предложен промышленный метод получения тетраалкилпроизводных свинца через легкодоступные комплексные соединения алюминия.
Ø Например, продуктом реакции хлорида метилмагния и хлорида свинца является тетраметилсвинец.
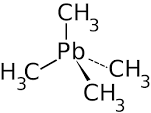
Тетраметилсвинец — простейшее алкилпроизводное металла свинца с формулой Pb(CH3)4, бесцветная жидкость, не растворимая в воде. Ядовит. Температура кипения 110 оС.
Получение:
1. Реакция свинца (или сплав с 6-10% натрия) с хлорметаном:
2Pb + 2CH3Cl → Pb(CH3)2 + PbCl2
2Pb(CH3)2 → PB(CH3)4 + Pb
2. Реакция хлорида свинца (II) с диметилцинком:
2PbCl2 + 2Zn(CH3)2 → Pb(CH3)4 + Pb + 2ZnCl2
3. Действие реактива Гриньяра на гексахлороплюмбат аммония:
(NH4)2[PbCl6] + 2CH3MgBr → Pb(CH3)4 +2 MgCl2 + 2NH4Cl
Ø Наиболее важным свинцовоорганическим соединением является тетраэтилсвинец (ТЭС).
Формула: (C2H5)4Pb.
Свойства:
Т кипения 80 оС
Тетраэтилсвинец — летучая ядовитая бесцветная жидкость, которая при температуре 0° переходит в парообразное состояние и через верхние дыхательные пути проникает в организм. Тетраэтилсвинец может проникать в организм и через неповрежденную кожу. Это вещество является сильным ядом, который избирательно поражает нервную систему, вызывая острые, подострые и хронические отравления. Последние обусловливаются функциональной кумуляцией, свойственной этому токсическому веществу.
Получение:
Получение ТЭС может быть осуществлено как химическим, так и электрохимическим методом. Один из химических методов получения основан на взаимодействии свинцово-натриевого сплава с хлористым этилом:
4PbNa + 4C2H5Cl  Pb(C2H5)4 + 3Pb + 4NaCl
Pb(C2H5)4 + 3Pb + 4NaCl
Однако эта суммарная реакция не раскрывает всех стадий процесса, так как кроме указанных соединений образуются также гексаэтилдисвинец, этилен, этан и бутан, что свидетельствует о протекании побочных реакций.
В частности, хлористый этил на первом этапе реакции, по-видимому, взаимодействует с металлическим натрием, образуя свободный этильный радикал:
С2H5Cl + Na  NaCl + C2H5*
NaCl + C2H5*
Т.е. реакция протекает по радикальному механизму, и этильный радикал является ответственным за дальнейший ход синтеза:
C2H5* + Pb  [PbC2H5]
[PbC2H5]
[PbC2H5] + C2H5*  Pb (PbC2H5)2
Pb (PbC2H5)2
Диэтилсвинец нестабилен и при температуре синтеза (30-50 оС) разлагается; при этом получаются тетраэтилсвинец и металлический свинец:
2 Pb (PbC2H5)2  Pb (PbC2H5)4 + Pb
Pb (PbC2H5)4 + Pb
Наряду с основным процессом протекают и побочные реакции. Например, образуется триэтилсвинец, который легко превращается в димер – гексаэтилдисвинец:
Pb (PbC2H5)2 + С2H5*  Pb (PbC2H5)3
Pb (PbC2H5)3  0,5Pb (PbC2H5)6
0,5Pb (PbC2H5)6
Этот димер при температуре выше 20 оС разлагается с образованием тетраэтилсвинца:
2Pb (PbC2H5)6  3Pb (PbC2H5)4 + Pb
3Pb (PbC2H5)4 + Pb
Кроме того, наблюдается взаимодействие этильных радикалов друг с другом с образованием этилена, этана и бутана.
Использование свинецорганических соединений ограничено частично из-за их токсичности, хотя токсичность составляет лишь 10% от уровня палладиевых соединений.
Химические свойства
Наиболее важный минерал - галенит PbS встречается практически во всех сульфидных рудах. При обжиге галенита получают PbO (свинцовый глет), из которого при нагревании с углем получают металлический свинец:
PbS 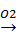 PbO
PbO 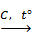 Pb
Pb
В разбавленных кислотах свинец практически нерастворим. Растворяется лишь в азотной кислоте и содержащей воздух уксусной кислоте с образованием нитрата и ацетата двухвалентного свинца. Растворением PbO в разбавленной хлороводородной кислоте может быть получен PbCl2:
PbO + 2 HCl  PbCl2 + H2O
PbCl2 + H2O
Металлический свинец, его галогениды и ацетат могут быть использованы для синтеза разнообразных органических производных.
Тетраорганоплюмбаны
Была показана принципиальная возможность получения свинецорганических соединений, в том числе тетразамещенных (тетраорганоплюмбанов PbR4), при взаимодействии металлического свинца и органогалогенидов:
Pb + RHal  RnPbHal4-n,
RnPbHal4-n,
где R = Alk, Ar; Hal = Cl, Br, I; n = 1 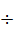 4.
4.
Активность алкилгалогенидов в реакции с металлическим свинцом убывает в следующем ряду:
CH3 > C2H5I > CH3Br > CH3Cl > C2H5Br > C2H5Cl
Обычно в синтезе используются катализаторы, лучше всего йодосодержащие соединения, хотя тонкоизмельченный свинец достаточно активен и без катализатора.
В прямом синтезе в качестве алкилирующих агентов также могут быть использованы алкильные эфиры серной и ортофосфорной кислот. Реакция осуществлялась с тонкораздробленным свинцом:
3 Pb + 2 R2SO4  R4Pb + 2 PbSO4
R4Pb + 2 PbSO4
9 Pb + 4 R3PO4  3 R4Pb + 2 Pb3(PO4)2
3 R4Pb + 2 Pb3(PO4)2
Низкие выходы продуктов реакции и образование трудноутилизируемых побочных продуктов снижают ценность этого метода.
Активность свинца в реакции с алкилгалогенидами может быть значительно повышена в присутствии таких реакционно-способных металлов, как литий магний, цинк, натрий и др. Однако в присутствии лития отмечено повышенное образование газообразных продуктов, происходящее, по-видимому, по схеме
2 Li + 2 RX  2 LiX + R-R
2 LiX + R-R
При проведении реакции в присутствии магния конверсия свинца достигает практически 100%, но в качестве побочного продукта отмечено образование значительных количеств гексаэтилдиплюмбана:
3 Pb + 5 Mg + 10 C2H5Cl  Pb(C2H5)4 + (C2H5)3PbPb(C2H5)3 + 5 MgCl2
Pb(C2H5)4 + (C2H5)3PbPb(C2H5)3 + 5 MgCl2
Для подавления побочных реакций используется ряд приемов, что существенно усложняет технологию производства.
Значительное повышение реакционной способности свинца достигается переводом его в активную форму в виде интерметаллического соединения со щелочными или щелочноземельными металлами (Li, Na, K, Ca, Mg). Эти соединения часто называют сплавами. При этом имеет место снижение энергии активации реакции алкилирования свинца, что позволяет осуществлять реакцию при умеренных температурах.
Предполагается, что реакция протекает в две стадии. На первой стадии имеет место разрушение связи металл - свинец по схеме:
M-Pb + RX  Pb* + RMX
Pb* + RMX
в результате чего образуется металлоорганическое соединение щелочного или щелочно-земельного металла и высвобождается металлический свинец в высокодисперсной активной форме Pb*, способный далее (вторая стадия) реагировать с алкилметаллогалогенидом, так и с алкилгалогенидом:
4 Pb* + 4 RMX  R4Pb + 4 MX + 3 Pb
R4Pb + 4 MX + 3 Pb
Наибольшее значение для промышленности имеет интерметаллическое соединение (сплав) свинца с натрием, причем оптимальное содержание натрия соответствует мономолекулярному составу Pb-Na. Хотя конверсия свинца за один цикл не превышает 25 %, сплавы свинца с натрием нашли самое широкое промышленное использование ввиду их относительной дешевизны, простоты получения и высокой эффективности.
Реакция между этилхлоридом и сплавом Pb - Na носит автокаталитический характер с резко выраженным периодом индукции, во время которого сплав под влиянием этилхлорида активируется. При повышении температуры и давления этилхлорида индукционный период уменьшается. Особенностью указанной реакции является существование определенной для каждого давления критической температуры, выше которой наступает резкое увеличение периода индукции.
Для объяснения наблюдаемых кинетических закономерностей процесса были предложены различные варианты механизма процесса: цепной радикальный, топохимический и электрохимический.
По теории цепного радикального процесса предполагается образование на поверхности сплава следующих активных центров:
Pb-Na + C2H5CI  РbC•2Н5 + NaCI
РbC•2Н5 + NaCI
Дальнейшие процессы могут быть представлены так:
PbC•2H5 + C2H5Cl  Pb(C2H5)2 + Cl•
Pb(C2H5)2 + Cl•
Pb-Na + Cl• 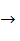 Pb• + NaCI
Pb• + NaCI
Pb• + C2H5CI  PbC•2H5 + Cl• и т. д.
PbC•2H5 + Cl• и т. д.
Адсорбция этилхлорида на поверхности сплава и образование кристаллов NaCl, которые являются зародышами для дальнейшей ускоряющейся реакции, позволили другим исследователям предположить топохимическое толкование механизма реакции согласно следующей схеме:
C2H5Cl  (C2H5Cl)адс
(C2H5Cl)адс
(C2H5Cl)адс + PbNa 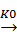 Pb(C2H5) + NaCl
Pb(C2H5) + NaCl
(C2H5Cl)адс + NaCl + PbNa 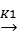 Pb(C2H5) + 2 NaCl,
Pb(C2H5) + 2 NaCl,
где (C2H5Cl)адс - адсорбированная поверхностью сплава молекула этилхлорида, К0, К1 - константы скоростей реакций (К0 > К1).
Установлено также, что добавки магния [0, 2 % (мас.)] и калия [1 % (мас.)] сокращают индукционный период.
Согласно электрохимической теории, сплав Pb - Na надо рассматривать как гальваническую пару, в которой положительно заряженный натрий является анодом, а свинец соответственно катодом. Взаимодействие алкилгалогенида со сплавом рассматривают как процесс коррозии сплава в алкилгалогениде, одновременно действующем в качестве алкилирующего агента и растворителя. При этом имеет место парный электродный процесс — анодное окисление натрия и катодное восстановление свинца:
4 Na  4 Na+ + 4ē
4 Na+ + 4ē
Pb 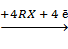 R4Pb + 4 X-
R4Pb + 4 X-
Электрохимическая и топохимическая теории имеют ряд общих положений. Они предполагают адсорбцию этилхлорида на поверхности сплава, что приводит к активации последнего. Схожи и дальнейшие превращения, имеющие место на натрии (анодный процесс) и свинце.
С 1922 г. промышленное производство тетраэтилплюмбана базируется на реакции сплава Pb - Na с этилхлоридом. Обычно в реактор загружают все необходимое количество свинца и небольшое количество этилхлорида. При температуре 50 — 60 °C происходит активация сплава, или так называемый «вызов» реакции. Далее при температуре 70 — 80 °С постепенно вводят оставшееся количество этилхлорида, процесс переходит во вторую стадию - синтез, сопровождающийся подъемом давления. После снижения максимального давления температуру немного повышают (80 - 85 С) и выдерживают некоторое время для обеспечения полноты реакции.
В результате реакции образуется смесь тетраэтилплюмбана, хлорида натрия и свинца, причем конверсия свинца в тетраэтилплюмбан не превышает 25 %. Образующийся в реакционной массе так называемый балластовый свинец обладает развитой поверхностью и высокой химической активностью, для сохранения которой процесс необходимо вести в инертной атмосфере. Повышение конверсии свинца до 40 - 60 % может быть достигнуто осуществлением двухступенчатого этилирования, для чего поднимают температуру свыше 100 °С, предварительно отделив от реакционной массы образовавшийся тетраэтилплюмбан, или вводят специальные термостабилизаторы для предотвращения его термического разложения.
Известны и другие способы получения тетраорганопроизводных свинца. Для этой цели, особенно в лабораторных условиях, может быть использовано взаимодействие металлоорганических соединений с галогенидами свинца. При этом, как правило, исходят из галогенидов двухвалентного свинца, которые значительно более устойчивы, чем галогениды четырехвалентного свинца. В ходе реакции имеет место ряд превращений, которые позволяют в конечном счете получить производные четырехвалентного свинца:
2 RMgX + РbХ2  [R2Pb] + 2 MgX2
[R2Pb] + 2 MgX2
3 [R2Pb]  R3PbPbR3 + Pb
R3PbPbR3 + Pb
2 R3PbPbR3, 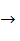 З R4Pb + Pb
З R4Pb + Pb
где x = Hal.
Помимо магнийорганических соединений могут быть использованы производные других металлов (Li, Na, Zn, Al, Hg и др.).
Ртутьорганические соединения позволяют получать соединения со связью ≡Pb-C≡, в органическом радикале которых находятся чувствительные к действию реактива Гриньяра группировки (например, -NО2, -COOR и др.). Вторым компонентом предложено использовать ацетаты свинца, которые вполне доступны:
4 R2Hg + Pb(OCOCH3)4  R4Pb + 4 RHgOCOCH3
R4Pb + 4 RHgOCOCH3
Еще один метод, позволяющий получать тетраорганопроизводные свинца, - электрохимический. По этому методу осуществляют электролиз некоторых металлоорганических соединений, например реактивов Гриньяра или комплексных солей алюминия, с использованием в качестве анода металлического свинца. Металлоорганическое соединение является поставщиком этильных радикалов.
Реактивы Гриньяра подвергаются электролизу в смеси растворителей тетрагидрофурана и дибутилового эфира диэтиленгликоля. Схематично процесс может быть представлен так:
RMgCI 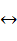 R- + MgCl+
R- + MgCl+
4 R- + Pb  R4Pb + 4 ē на аноде
R4Pb + 4 ē на аноде
4MgCI+ + 4 ē  2 Mg + 2 MgCl2 на катоде.
2 Mg + 2 MgCl2 на катоде.
Металлический магний реагирует с алкилгалогенидом, взятым в избытке, с образованием реактива Гриньяра.
Электролизу могут быть подвергнуты и некоторые комплексные соли алюминия, содержащие этильный радикал. Электролиз смеси тетраэтилалюмината калия и комплексной соли фторида калия с триэтилалюминием на свинцовом аноде и ртутном катоде протекает по следующей схеме:
KAl(C2H5)4 + KF*Al(C2H5)3 + Pb + xHg  Pb(C2H5)4 + K(Hg)x + KF*2Al(C2H5)3
Pb(C2H5)4 + K(Hg)x + KF*2Al(C2H5)3
Свинцовый анод растворяется с образованием тетраэтилсвинца, а на катоде образуется амальгама калия. Тетраэтилплюмбан отделяют, а электролит – комплексную соль KF*2Al(C2H5)3 обрабатывают этиленом и гидридом натрия:
KF*2Al(C2H5)3 + С2H4 +NaH  KF*Al(C2H5)3 + NaAl(C2H5)4
KF*Al(C2H5)3 + NaAl(C2H5)4
Далее тетраэтилалюминат нария при взаимодействии с амальгамой калия вновь образует тетраэтилалюминат калия, который опять поступает на электролиз.
Большое разнообразие методов получения из доступного сырья делает тетраарганопроизводные свинца вполне доступными соединениями.
Тетраалкилплюмбаны – как правило, тяжелые маслянистые жидкости с высокими температурами кипения. Тетраарилпроизводные – твердые кристаллические соединения. Вследствие термической неустойчивости перегонять эти соединения необходимо в вакууме или с водяным паром. Как уже отмечалось выше, связь ≡Pb-C≡ наиболее реакционноспособна среди элементов IV Б группы. Она легко при минусовых температурах расщепляется при действии галогенов. Процесс протекает ступенчато, и полнота прохождения реакции зависит от температуры.
R4Pb + Cl2 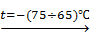 R3PbCl + RCl
R3PbCl + RCl
R3PbCl + Cl2 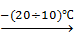 R2PbCl2 + RCl
R2PbCl2 + RCl
Фенильный радикал отщепляется легче, и при -75 оС отщепляются сразу два радикала:
(C6H5)4Pb + Br2 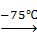 (C6H5)2PbBr2 + 2 C6H5Br
(C6H5)2PbBr2 + 2 C6H5Br
Деалкилирование (деарилирование) имеет место и при действии газообразных галогенводородов, которые являются более мягкими деалкилирующими агентами, чем галогены. Регулируя условия реакции, можно отщепить один или два радикала:
R4Pb + HCl 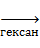 R3PbCl + RH
R3PbCl + RH
R3PbCl + HCl  R2PbCl2 + RH
R2PbCl2 + RH
Реакцию предпочтительнее проводить на холоде.
Аналогичным образом ведут себя и концентрированные галогенводородные кислоты. Умеренное нагревание с хлороводородной кислотой позволяет отщепить один или два радикала, при продолжительном нагревании могут отщепляться все четыре радикала.
Органические кислоты жирного ряда также при нагревании отщепляют органические радикалы от атома свинца:
(C2H5)4Pb + CH3COOH 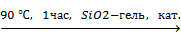 (С2H5)3PbOCOCH3 + C2H6
(С2H5)3PbOCOCH3 + C2H6
В более жестких условиях возможно отщепление всех четырех радикалов с образованием диацетата свинца. Аналогичным образом реагируют фенолы и меркаптаны.
В перечисленным выше реакциях (с галогеноводородами, галогеноводородными и органическими кислотами) арильный радикал отщепляется значительно легче. В этом случае труднее регулировать степень отщепления, поскольку, как правило, отщепляются сразу два радикала. В смешанных соединениях, содержащих как алкильный, так и арильный радикалы, легче отщепляется последний.
Тетраалкил(арил)плюмбаны легко окисляются при действии кислорода. Тетраэтилплюмбан при нагревании в растворе органического растворителя при температуре ≥ 80 оС образует сложную смесь продуктов, состоящую из этана, этилена, бутана, ацетальдегида, гидроксида триэтилплюмбана, дигидроксида диэтилплюмбана, оксида и пероксида свинца:
Pb(C2H5)4 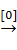 C2H6 + CH2=CH2 + C4H10 + CH3CHO + (C2H5)3PbOH + (C2H5)2Pb(OH)2 + PbO + PbO2
C2H6 + CH2=CH2 + C4H10 + CH3CHO + (C2H5)3PbOH + (C2H5)2Pb(OH)2 + PbO + PbO2
Окисление тетраэтиплюмбана протекает с самоускорением. Процесс является сложной гетерогенной реакцией, включающей кроме химических стадий ряд физических процессов (растворение кислорода, выделение из реакционной смеси осадка и газообразных продуктов др.)
Тетраалкильные производные свинца менее устойчивы к термо- и фотораспаду, чем органические проивзодные других элементов IV Б группы. Показано, что термораспад тетраэтилплюмбана в газовой фазе протекает с образованием свободных радикалов:
(С2H5)4Pb 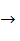 Pb• + •C2H5
Pb• + •C2H5
Дальнейшее превращение которых приводят к образованию сложной смеси продуктов. При осуществлении реакции при температуре 233-267 оС и давлении 5-15 мм рт. ст. на начальной стадии отмечено образование водорода, этана, этилена и н -бутана. В дальнейшем эта смесь усложняется, в частности, за счет взаимодействия этилена со свободными радикалами. Всего выделено и идентифицировано 17 продуктов реакции, содержащих от 1 до 6 атомов углерода. Другими исследователями отмечено, что термический распад тетраэтилплюмбана или его раствора в изооктане при 105-170 оС является сложным процессом, протекающим с промежуточным образованием менее алкилированных соединений – гексаэтилдиплюмбана и диэтилсвинца (II):
(С2H5)4Pb  (С2H5)3PbPb(С2H5)3
(С2H5)3PbPb(С2H5)3  (С2H5)2Pb
(С2H5)2Pb  Pb
Pb
Выделящийся металлический свинец катализирует процесс термораспада.
Следы кислорода воздуха ингибируют процесс термораспада. Более эффективными ингибиторами являются галоидные алкилы или продукты их взаимодействия с тетраэтилплюмбаном.
Свинецорганические соединения легко разлагаются при действии УФ-света. Фотолиз тетраметилплюмбана в газовой фазе дает свинец и этан:
(CH3)4Pb 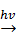 Pb + 2 C2H6
Pb + 2 C2H6
При пободной схеме в растворе бензола и при действии УФ-света или нагревании распадается тетрафенилплюмбан:
(C6H5)4Pb 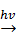 Pb + 2 C2H5 – C6H5
Pb + 2 C2H5 – C6H5
Органогалогенплюмбаны
Органогалогенплюмбаны RnPbHal4-n являются одним из важнейших классов свинецорганических соединений. Способы их получения также достаточно хорошо разработаны. Наибольшее значение для их получения имеют реакции деалкилирования тетраорганоплюмбанов галогенами, галогеноводородами или галогеноводородными кислотами:
R4Pb 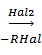 R3PbHal
R3PbHal 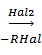 R2PbHal2
R2PbHal2 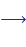 …
… 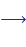 R4Pb
R4Pb 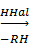 R3PbHal
R3PbHal 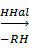 …
…
В зависимости от природы деалкилирующего агента и условий проведения реакции можно получать продукты различной степени замещения. Подробнее об этом уже рассказывалось при рассмотрении химических свойств тетраорганоплюмбанов. Также уже упоминалось о возможности получения органогалогенплюмбанов прямым синтезом из металлического свинца и органогалогенидов, однако этот метод большого распространения не получил.
Органогалогенплюмбаны могут быть жидкими или твердыми кристаллическими веществами. Соединения типа Alk3PbHal и Alk2PbHal2 хорошо растворяются в обычных органических растворителях и даже в воде. Галогениды Ar3PbHal и Ar2PbHal2 не растворяются в органических растворителях и не плавятся. Галогениды три- и диалкилсвинца значительно менее устойчивы, чем соответствующие соединения ароматического ряда. Соединения типа типа Alk3PbHal3 и ArPbHal3 очень неустойчивы и, по-видимому, могут разлагаться в момент образования.
По химическим свойствам органоплюмбаны напоминают соответствующие оловоорганические соединения. Они способны к реакции гидролиза, этерификации, ацидолиза и т.д. легко гидролизуются растворами щелочи и аммиака, причем склонность к гидролизу увеличивается с уменьшением числа органических радикалов у атома свинца. Характерной особенностью свинецорганических соединений является относительная устойчивость к гидроксидам три- и диалкилплюмбанов:
(C2H5)3PbCl 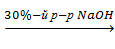 (C2H5)3PbOH
(C2H5)3PbOH
Реакцию рекомендовано осуществлять в эфирном или бензольном растворе.
С металлическим натрием гидроксид триэтилплюмбана образует димер – гексаэтилдиплюмбооксан:
(C2H5)3PbOH 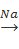 (C2H5)2PbOPb(C2H5)3
(C2H5)2PbOPb(C2H5)3
Вместо раствора щелочи для гидролиза предложено использовать влажный гидроксид серебра. Аналогично могут быть получены гидроксиды и соотвествующие димеры с другими алкильными или арильными радикалами у свинца.
Гидролиз дигалогендиалкилплюмбанов щелочью или влажным гидроксидом серебра приводит к образованию дигидроксидиалкилплюмбанов, которые могут быть выделены в чистом виде или в виде кристаллогидратов:
(C2H5)2PbCl2 + 2 AgOH 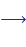 (C2H5)2Pb(OH)2 + 2AgCl.
(C2H5)2Pb(OH)2 + 2AgCl.
Гидролиз водной щелочью диарилдигалогенплюмбанов приводит к полимерным оксидам, которые не плавятся и не растворяются в органических растворителях:
Ar2PbHal2  [Ar2PbO]n.
[Ar2PbO]n.
При гидролизе органотригалогенплюмбанов предполагается образование органоплюмбановых кислот по схеме:
RPbCl3  RPPbOOH.
RPPbOOH.
При добавлении минеральных галогеноводородных или органических кислот к водным или спиртовым растворам гидроксиорганоплюмбанов образуются соответствующие производные со связями ≡Pb—Hal или ≡Pb—OAc. При этом следует учитывать, что при взаимодействии гидрокситриалкилплюмбанов с органическими кислотами может иметь место диалкилирование органоплюмбанов.
Органогалогенплюмбаны реагируют с алкоголятами натрия в среде эфира, ТГФ или бензола, давая соответствующие свинецорганические алкоксисоединения:
R3PbHal3 + R`ONa  R3PbOR + NaHal.
R3PbOR + NaHal.
С силанолятами натрия образуются соединения:
(CH3)3PbBr + (CH3)3SiONa 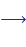 (CH3)3PbOSi(CH3)3 + NaBr.
(CH3)3PbOSi(CH3)3 + NaBr.
Алкилплюмбосилоксаны отличаются резким неприятным запахом и высокой токсичностью. Взаимодействие с солями органических кислот приводит к получению органоацилоксиплюмбанов:
R3PbCl3 + R`COONa 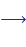 R3PbOCOR` + NaCl.
R3PbOCOR` + NaCl.
Органоалкокси(арокси)плюмбаны и органоацилоксиплюмбаны
Некоторые реакции, приводящие к получению соединений свинца ≡Pb—O—C≡, уже упоминались выше. Это деалкилирование тетраорганоплюмбанов органическими кислотами и фенолами, взаимодействие органогалоидплюмбанов с алкоголятами спиртов и солями органических кислот, свинецорганических гидроксидов с органическими кислотами:
R4Pb + R`COOH  R3PbOCOR` + RH;
R3PbOCOR` + RH;
R3PbCl + R`ONa  R3PbOR` + NaCl;
R3PbOR` + NaCl;
R3PbCl + R`COONa  R3PbOCOR`+ NaCl;
R3PbOCOR`+ NaCl;
R3PbH + R`COOH  R3PbOCOR`+ H2O.
R3PbOCOR`+ H2O.
Свинецорганические гидроксиды инертны к спиртам, а гексаалкилдиплюмбоксаны легко с ними реагируют:
(C2H5)3PbOPb(C2H5)3 + ROH  (C2H5)3PbOH + (C2H5)3PbOR
(C2H5)3PbOH + (C2H5)3PbOR
(R = CH3, C2H5, C6H5CH2 и др.).
Оксиды диарилсвинца и арилплюмбоновые кислоты при нагревании с орагническими кислотами с хорошими выходами превращаются в соответствующие ацильные производные:
Ar2PbO + 2RCOOH  Ar2Pb(OCOR)2 + H2O;
Ar2Pb(OCOR)2 + H2O;
ArPbOOH + 3RCOOH  ArPb(OCOR)3 + 2H2O.
ArPb(OCOR)3 + 2H2O.
Для синтеза свинецорганических ацилатов может быть с успехом использована реакция переацилирования, напрмер:
(С6H5)2Pb(OCOCH3)2 + 2CH2=C(CH3)-COOH  (C6H5)2Pb(OCO(CH3)C=CH2)2 + 2CH3COOH.
(C6H5)2Pb(OCO(CH3)C=CH2)2 + 2CH3COOH.
Алклкси- и ацилоксиплюмбаны могут быть жидкими или твердыми кристаллическими веществами, растворимы в большинстве обычных растворителей. Легко гидролизуются даже влагой воздуха. При гидролизе образуются соответствующие плюмбанолы, которые дали могут конденсироваться с образованием плюмбоксанов:
(С6H5)2Pb(OCOCH3)2 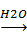 (C6H5)2(OH)Pb(OCOCH3)
(C6H5)2(OH)Pb(OCOCH3) 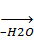 CH3COOPb(C6H5)2OPb(C6H5)2OCOCH3.
CH3COOPb(C6H5)2OPb(C6H5)2OCOCH3.
Гидролиз ацилоксиплюмбанов протекает значительно легче, чем гидролиз соответствующи