Гр. 181 СА
Химия 3
Тема урока: Классификация реакций в органической химии. Предельные углеводороды, строение, изомерия, свойства и применение на их основе.
Тип урока: Изучение нового материала.
План урока:
1. Изучите основные понятия темы (глава1, параграф 4 стр.19-36)
2. Выполните практическую работу.
3. Для изучения и выполнения заданий используйте учебное пособие по химии:
Новошинский И.И. Органическая химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений / И.И. Новошинский, Н.С. Новошинская. – 5 –е изд. – М.: ООО «ТИД «Русское слово - РС», 2011. – 176с.
4. Выполненное задание направить мне на ЭЛЕКТРОННЫЙ АДРЕС: lud.bas@mail.ru
(укажите фамилию и группу).
Ход урока:
1. Предельные углеводороды – это углеводороды с общей формулой
Сn Н2n -2 , которые не присоединяют водород и другие элементы.
Если присмотреться к поверхности заросшего пруда, болота или другого водоёма, можно заметить, как на поверхность поднимаются пузырьки газа. С давних пор люди называли его болотным газом. И только в 1785 году французский химик Клод Луи Бертолле (открывший бертолетову соль) установил, что в состав болотного газа входят два элемента – углерод и водород. Впоследствии было выяснена молекулярная формула вещества СН4. Болотный газ получил название «метан». Откуда берётся этот газ в природе? Незримо для человека работает природная лаборатория микроорганизмов. Особые бактерии без доступа воздуха разлагают клетчатку отмерших растений. Этот процесс играет огромную роль в круговороте углерода в природе.
В 30-х годах XIX века немецкий химик К.Райхенбах выделил из буковой смолы смесь высших насыщенных углеводородов. Считая, что он получил индивидуальное вещество, Райхенбах назвал его парафином. Это слова в переводе с латинского означает не обладающий сродством. Действительно, полученное вещество при обычных условиях не взаимодействовало с кислотами и щелочами, было устойчиво к окислению. К середине XIX века химикам стали известны и другие углеводороды, имеющие подобное строение: этан, пропан, бутан, гексан. Все они имели свойства подобные веществу, полученному Райхенбахом, поэтому в 1868 году английский химик Х.Уэтс предложил объединить их в общий класс и назвать парафинами.
|
|
По международной номенклатуре их называют алканами, исторически сложившееся название алканов – парафины (с лат. малоактивный). Их также называют насыщенными, т.к. все валентности атомов С насыщены атомами водорода. Простейшим представителем класса предельных углеводородов является метан.
Особенности пространственного строения предельных углеводородов.
СН4 – молекулярная формула (качественный, количественный состав);
Молекула метана в действительности имеет форму тетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. В центре тетраэдра находится атом углерода, а все его четыре валентности направлены к вершинам тетраэдра. Физическими методами исследования установлено, что валентные углы равны 109о28'.
1. Почему молекула метана имеет такую пространственную форму?
2. Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра?
Ответ следует искать в электронном строении атома углерода и молекулы метана. С 1S2 2S2 2P2 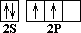 ––> C * 1S2 2S1 2P3
––> C * 1S2 2S1 2P3 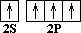
|
|
(основное состояние) (возбужденное состояние)
Так как на втором энергетическом уровне Р-подуровне есть свободная орбиталь, то на неё переходит один из 2 S 2 -электронов. В результате этого атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, т.е. становится четырёхвалентным. Облака всех четырёх валентных электронов атома углерода выравниваются, становятся одинаковыми. При этом они принимают форму вытянутых в направлении к вершинам тетраэдра восьмёрок.
Явление, при котором происходит смешение и выравнивание по форме и энергии электронных облаков, называется гибридизацией.
Так как гибридизации подвергаются один S и три Р -электрона, то такое состояние называется SP3 -гибридизацией.
Несимметричное распределение электронной плотности означает, что вероятность нахождения электрона по одну сторону от ядра больше, чем по другую. Гибридные электронные облака вытянуты в пространстве под углом 109о28' к вершинам воображаемого тетраэдра, и в этом направлении они перекрываются с электронными облаками атомов водорода.
Итак, молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода, тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода.