Существует много углеводов, сходных с метаном, то есть гомологов метана. В их молекулах имеются 2, 3, 4 и более атомов углерода. Каждый последующий углеводород отличается от предыдущего группой атомов СН2. Например, если к формуле СН4 прибавить группу СН2, получим следующий углеводород С2Н6 – этан – гомолог метана. Группа СН2 называется гомологической разностью.
Для предельных углеводородов характерна общая формула: СnH2n+2, где n – целое число атомов углерода. Пример:
n=5 C5Н2Х5+2=С5Н12 – пентан
n=8 C8Н2Х8+2=С8Н18 – октан
Для названия углеводородов используют две номенклатуры: историческую (случайные названия) и систематическую.
Для составления названия алканов по систематической номенклатуре нужно:
1.Выбрать самую длинную неразветвленную цепь углерода.
2.Пронумеровать эту цепь таким образом, чтобы заместители, которые в молекулах углеводородов замещают атомы водорода, были ближе к началу цепи.
3.Указать цифрой место и название заместителя, затем название основной цепи с суффиксом –ан. Для этого нужно знать название радикалов (образуются при отщеплении атома водорода от атома углерода), которые образуются от названий соответствующих углеводородов, путём замены суффикса –ан на –ил.
СН4 - метан, СН3 - метил
С2Н6 – этан, С2Н5 – этил
С3Н8 – пропан, С3Н7 – пропил
Для примера рассмотрим молекулу гексана и составьте несколько изомеров, дав им названия по международной номенклатуре.
Получение:
Лабораторные способы:
1.при нагревании ацетата натрия с твердым гидроксидом натрия
CH3COONa + NaOH → CH4 + Na2CO3
ацетат натрия
2. реакцией Вюрца: CH3Cl + 2Na → CH3 - CH3 + 2NaCl
хлорметан этан
Физические свойства. С увеличением Mr закономерно изменяются: а) агрегатное состояние углеводородов С1-С4 – газы, С5-С16 – жидкости, n > 16 – твердые вещества, б) увеличиваются tпл и tкип., в) уменьшается растворимость.
Химические свойства.
Предельные углеводороды характеризуются малой реактивной способностью. Сегодня на уроке познакомимся с взаимодействием алканов с кислородом, галогенами, термическим разложением, изомеризацией.
1. Горючесть алканов.
При поджигании (t = 600oС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. СnН2n+2 + O2 → CO2 + H2O + Q например: СН4 + 2O2 → CO2 + 2H2O + Q
Смесь метана с кислородом или воздухом при поджигании может взрываться. Наиболее сильный взрыв получается при объёмных отношениях 1: 2 (с кислородом) или 1: 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью.
Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства. С3Н8 + 5O2 → 3CO2 + 4H2O + Q Гор18ние пропан-бутановой смеси можно продемонстрировать на примере газовой зажигалки.
При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов.
2. Разложение алканов. СnН2n+2 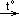 C + H2↑; СН4
C + H2↑; СН4 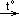 C + 2H2↑;С4Н10
C + 2H2↑;С4Н10 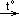 4C + 5H2
4C + 5H2
Метан в термическом отношении более устойчив, чем другие алканы. Причина этого в достаточной прочности С – Н связей.
3. Реакции замещения (протекают с галогенами и другими окислителями при определённых условиях: свет, температура).
СН4 + Cl2 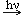 CH3Cl + HCl СН3Cl + Cl2
CH3Cl + HCl СН3Cl + Cl2 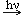 CH2Cl2 + HCl
CH2Cl2 + HCl
СН2Cl2 + Cl2 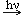 CHCl3 + HCl СНCl3 + Cl2
CHCl3 + HCl СНCl3 + Cl2 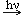 CCl4 + HCl
CCl4 + HCl
Механизм цепных реакций достаточно сложен, объяснение ему было дано русским учёным Н.Н. Семёновым, за что он в 1956 г. был удостоен Нобелевской премии.
2. Самостоятельная работа:
Задание 1: Выполните тест
1. Укажите ошибочное определение алканов:
а) предельные углеводороды; б) карбоциклические соединения (в молекулах имеются циклы); в) насыщенные углеводороды; г) парафиновые углеводороды.
2. Общая формула алканов:
а) СnH2n; б) СnH2n+1; в) СnH2n+2; г) СnН2n-2.
3. Признаки, характеризующие строение алканов:
а) SP3 -гибридизация, плоская форма молекул  120о,
120о, 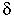 и
и 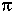 -связи;
-связи;
б) SP -гибридизация, линейная форма молекул 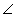 180о,
180о, 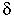 и
и 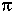 -связи;
-связи;
в) SP3 -гибридизация, форма молекул – тетраэдр 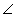 109о28',
109о28', 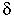 -связи.
-связи.
4. Невозбуждённый атом углерода имеет электронную конфигурацию:
а) 1 S 22 S 12 P 3; б) 1 S 22 S 22 P 2; в) 1S22S22P3; г) 1S22S22P4.
5. Возбужденный атом углерода имеет электронную конфигурацию:
а) 1S22S22P3; б) 1S22S22P2; в) 1S22S22P4; г) 1S22S12P3.
6. Всем алканам присущи свойства:
а) вступать в реакцию замещения; б) окисляться при обычных условиях;
в) гореть в кислороде г) реагировать с активными металлами.
Задание 2: Приготовить сообщения на темы:
1. Применение предельных углеводородов.
2. Классификация реакций в органической химии.