Определение. Внутренней энергией какого-либо тела называется энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Она является функцией внутреннего состояния системы. Для идеального газа внутренняя энергия состоит из суммы энергий поступательного, вращательного и колебательного движений молекул. (Заметим, что в общем случае во внутреннюю энергию входят энергия взаимодействия атомов, энергия электронных оболочек, внутриядерная энергия и др.). Внутреннюю энергию одного моля идеального газа найдём, умножив число Авогадро на среднюю энергию одной молекулы:

Учитывая, что  , получим:
, получим:

|
т.е. внутренняя энергия идеального газа является функцией температурыи пропорциональна ей, а также зависит от числа степеней свободы молекул. То, что внутренняя энергия является функцией состояния системы, означает, что всякий раз, когда система оказывается в данном состоянии, ее внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе системы из одного состояния в другое будет всегда равно разности значений внутренней энергии в этих состояниях, независимо от пути, по которому совершался переход.
Свяжем внутреннюю энергию с теплоёмкостью. По определению теплоёмкость в процессе при постоянном объёме  , для идеального газа
, для идеального газа

|
Соответственно

|
3. Основное уравнение молекулярно-кинетической теории.
Постановка задачи. Требуется получить связь между макропараметрами – давлением P, температурой T, с микропараметрами – массой молекулы m, её скоростью 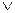 и концентрацией молекул n.
и концентрацией молекул n.
Пусть имеется некоторый сосуд с газом. Будем считать, что молекулы могут двигаться вдоль осей x, y, z. Выберем на стенке сосуда участок поверхности  (Рис. 7.2). Если в сосуде N молекул, то вследствие равновероятности этих направлений вдоль каждой оси будет двигаться
(Рис. 7.2). Если в сосуде N молекул, то вследствие равновероятности этих направлений вдоль каждой оси будет двигаться 

| молекул. Половина из них движется вдоль данного направления, т.е. 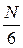 (ось имеет два направления).
Предположим, что все молекулы движутся с одинаковой скоростью, равной
(ось имеет два направления).
Предположим, что все молекулы движутся с одинаковой скоростью, равной  . Тогда за время . Тогда за время  до элемента стенки до элемента стенки  долетят молекулы, заключённые в объёме параллелепипеда с основанием долетят молекулы, заключённые в объёме параллелепипеда с основанием  и высотой и высотой   . Число этих молекул равно . Число этих молекул равно
|
| Рис. 7.2 |
произведению плотности молекул 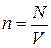 (где
(где 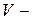 объём сосуда) на объём
объём сосуда) на объём 
 , т.е. число молекул, летящих к площади
, т.е. число молекул, летящих к площади
 (1)
(1)
По закону сохранения импульса каждая молекула при ударе о стенку передаёт ей импульс (удар считается упругим), равный изменению импульса молекулы (Рис. 7.3, а, б).

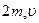 . (2)
. (2)
По 2-му закону Ньютона:
 , (3)
, (3)
где  сила, действующая со стороны молекулы на стенку;
сила, действующая со стороны молекулы на стенку;  длительность взаимодействия молекулы со стенкой.
длительность взаимодействия молекулы со стенкой.
Для всех молекул, находящихся в параллелепипеде:

|  , где , где
 средняя сила, с которой молекулы действуют на стенку средняя сила, с которой молекулы действуют на стенку  . Учитывая соотношение (3): . Учитывая соотношение (3):
 ,
подставляя (1) и (2) в последнее соотношение, получим: ,
подставляя (1) и (2) в последнее соотношение, получим:
| ||||
| рис. 7.3 |
 .
.
Поделив правую и левую части на  , учитывая, что
, учитывая, что
по определению давления  и производя необходимые сокращения, получим
и производя необходимые сокращения, получим  или
или  .
.
Если в выводе учесть, что скорости отдельных молекул могут быть различными, то величину  следует заменить средней величиной квадрата скорости
следует заменить средней величиной квадрата скорости  .
.
А так как средняя энергия поступательного движения молекулы
 ,
,
то
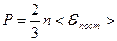
| Основное уравнение молекулярно-кинетической теории. |
Физический смысл уравнения: давление, оказываемое газом на стенки сосуда прямо пропорциональна числу молекул в единице объёма и средней кинетической энергии поступательного движения одной молекулы.
4. Уравнение состояния идеального газа Клапейрона-Менделеева
(Клапейрон (1799 – 1864) – французский физик и инженер; Менделеев Дмитрий Иванович (1834 – 1907) – великий русский учёный). Опыт даёт, что при небольших плотностях газы подчиняются уравнению (Клапейрона):
 .
.
В соответствии с законом Авогадро моли всех газов занимают при одинаковых условиях одинаковый объём.
Отсюда const будет одинакова для всех газов, если количество равно 1 молю. Обозначив const=R, получим (Менделеев):
Уравнение состояния идеального газа для одного моля, где газовая постоянная  , а
, а  - объем 1 моля газа.
- объем 1 моля газа.

|
Если у нас имеется  молей, то объём будет
молей, то объём будет  ,
,  , подставим в уравнение состояния для 1-го моля:
, подставим в уравнение состояния для 1-го моля:
 или
или  .
.
Количество вещества  можно представить в виде отношения массы газа m к молярной массе газа М
можно представить в виде отношения массы газа m к молярной массе газа М  и окончательно уравнение состояния идеального газа (уравнение Клапейрона-Менделеева) для массы газа m:
и окончательно уравнение состояния идеального газа (уравнение Клапейрона-Менделеева) для массы газа m:
 (4)
(4)
Следствие из уравнения Клапейрона-Менделеева. Газовую постоянную выразим как  . Произведение
. Произведение  , тогда
, тогда  . Разделим обе части последнего уравнения на V и, учитывая, что
. Разделим обе части последнего уравнения на V и, учитывая, что
 концентрация молекул, получим
концентрация молекул, получим
 (5)
(5)
Оба уравнения (4) и (5) представляют различные формы записи уравнения состояния идеального газа. Это уравнение позволяет достаточно просто оценить параметры газа, если его можно считать идеальным.
Вопросы для самоконтроля.
1. Какой газ называется идеальным? Опишите модель идеального газа.
2. Что называется числом степеней свободы механической системы i?
3. Чему равно число i для одноатомной и многоатомной молекул? Обоснуйте свой ответ.
4. Что утверждает закон равнораспределения?
5. Как зависит внутренняя энергия идеального газа от его абсолютной температуры?
6. Как объясняют давление газа в МКТ?
7. Запишите основное уравнение молекулярно-кинетической теории. Что называют микро- и макропараметрами системы?
8. Проделайте вывод основного уравнения МКТ.
9. Что позволяет рассчитать уравнение состояния идеального газа Клапейрона-Менделеева?
Лекция №8