ЛЕКЦИЯ 6
ОБРАЗОВАНИЕ И РАСТВОРЕНИЕ ОСАДКОВ
В АНАЛИЗЕ
1. Произведение растворимости и растворимость. Условие выпадения осадка.
2. Произведение растворимости при неполной диссоциации малорастворимого соединения.
3. Факторы, влияющие на полноту осаждения.
4. Растворение осадков
Произведение растворимости и растворимость.
Условие выпадения осадка.
Гетерогенными называются химические и физико-химические процессы, которые происходят в системах, состоящих из нескольких фаз. Фазы могут быть жидкими, твердыми и газообразными.
Отдельные части гетерогенной системы, разграниченные поверхностями раздела, называются фазами.
В лекции будет рассмотрено фазовое равновесие жидкость – твердое вещество, как имеющее наибольшее значение для разделения элементов, качественного и количественного определения.
Рассмотрим равновесие в системе малорастворимого сильного электролита АаВв, опустив для простоты заряды ионов:
АаВвтв ó aA + вВ
Это равновесие описывается термодинамической константой равновесия:
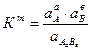
Активность твердой фазы есть величина практически постоянная, произведение двух констант даст новую константу, которую называют термодинамическим произведением растворимости (ПР):
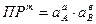
В растворе над осадком малорастворимого сильного электролита произведение активностей ионов в степенях соответствующих стехиометрических коэффициентов есть величина постоянная при данных условиях (температура, давление, растворитель).
В немецкой литературе ПР обозначается Lp (löslichkeitsprodukt), в английской – Sp (solubility product).
ПРт = f (T, P, природы растворителя)
Значения термодинамического произведения растворимости для Различных соединений приведены в справочниках (например, в справочнике Ю.Ю. Лурье. Справочник по аналитической химии).
В реальных условиях на равновесия влияют электростатические силы (ионная сила растворов) и химические взаимодействия (побочные реакции с ионами осадка), вследствие чего растворимость осадка меняется.
Влияние электростатических взаимодействий
В присутствии посторонних ионов, создающих вокруг ионов осадка ионную атмосферу, но не вступающих с ними в химические реакции, а также при достаточно большой концентрации собственных ионов (при ПРт> 1·10-7) растворимость осадка меняется. В этом случае равновесие раствор – осадок описывается ПРр.
μ ≠ 0; f ≠ 1;
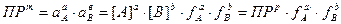
Реальное произведение растворимости зависит от температуры, давления, природа растворителя и ионной силы раствора.
ПРр = f (T, P, природы растворителя, μ)
Т.е. произведение равновесных концентраций малорастворимого электролита в растворе над осадком в степенях соответствующих коэффициентов есть величина постоянная при постоянной температуре, давлении и ионной силе раствора.
Как изменяется растворимость в присутствии посторонних сильных электролитов, создающих в растворе ионную силу? Рассмотрим для примера насыщенный раствор сульфата свинца PbSO4 и добавим к нему раствор нитрата калия KNO3. Этот электролит не имеет общих ионов с осадком. Но он увеличивает ионную силу раствора над осадком.
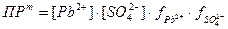
Растворимость S сульфата свинца определяется равновесными концентрациями ионов свинца и сульфат-ионов, которые равны:
S = [Pb2+] = [SO42-] = 
С ростом ионной силы раствора μ величины коэффициентов активности f(Pb2+) и f(SO42-) уменьшаются, а значение ПРт остается постоянным. Значит, с ростом ионной силы растворимость сульфата свинца увеличивается.
Увеличение растворимости осадка малорастворимого сильного электролита в присутствии постороннего сильного электролита называется солевым эффектом.
Физическая причина повышения растворимости ясна: стесненные в своих движениях межионными силами ионы Pb2+ и·SO42- реже сталкиваются с поверхностью кристаллов PbSO4. В результате нарушается равновесие – процесс перехода Pb2+ и·SO42- в раствор оказывается более интенсивным, чем процесс их осаждения. Затем равновесие устанавливается при новой, большей концентрации ионов в растворе.