Теория строения органических соединений М.И. Бутлерова
Основные положения теории химического строения
В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений. Согласно этой теории:
- атомы в органических молекулах соединены друг с другом в соответствии с валентностью, при этом углерод всегда четырехвалентен;
- порядок соединения атомов в молекуле называется химическим строением;
- свойства веществ определяются не только их составом, но и химическим строением;
- атомы в молекулах оказывают взаимное влияние друг на друга;
- исходя из строения молекулы можно предсказать свойства вещества, и, наоборот, на основании химических свойств можно предсказать строение вещества.
Углеводородные цепи могут быть как открытыми (алициклическими), так и замкнутыми (циклическими), как прямыми, так и разветвленными.
Определение
Гомологи — органические соединения, принадлежащие к одному классу веществ, обладающие сходным строением и свойствами, но отличающиеся друг от друга по составу на одну или несколько групп СНСН2 и отвечающие одной общей формуле.
Способы отображения строения молекул. Формулы. Модели
Структуру вещества, то есть порядок соединения атомов в молекуле, отображает структурная формула, в которой связи между атомами (или группами атомов) изображаются в виде черточек: одна черточка означает одну связь или одну общую электронную пару. Поскольку углерод в органических соединениях всегда четырехвалентен, то каждый атом углерода может образовывать четыре связи (четыре черточки).
По количеству соседних углеродных атомов, атомы углерода в молекуле подразделяются на первичные (один «сосед»), вторичные (два «соседа»), третичные (три «соседа») и четвертичные (четыре «соседа»). Так, концевые атомы в молекуле углеводородов всегда первичные, в линейных молекулах промежуточные атомы — вторичные, а в разветвленных могут появляться третичные и (или) четвертичные атомы углерода.
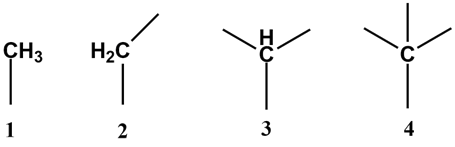
Для отображения органических молекул используют молекулярные или брутто-формулы, которые представляют собой сокращенную форму записи количественного и качественного состава.
Например, запись СНС2Н6 означает, что молекула вещества состоит из 2 атомов углерода и 6 атомов водорода. Для каждого класса органических соединений можно вывести общую формулу, отвечающую количественному составу всех гомологов. Эту формулу называют общей формулой гомологического ряда. Вещества, принадлежащие к одному классу, отвечают одной общей формуле.
Сравним структурные формулы простейших углеводородов: метана, этана и пропана.
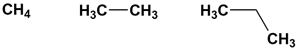
Молекулярная формула метана СН4, этана С2Н6, пропана С3Н8. Видно, что формула этана отличается от формулы метана на одну группу СН2. Аналогично, состав молекул пропана и этана также отличается на одну группу СН2. Следовательно, все эти вещества являются гомологами и относятся к гомологическому ряду метана. Прибавив к формуле пропана указанную гомологическую разницу СН2, получим формулу следующего представителя этого гомологического ряда — С4Н10 (бутан):

Для состава С4Н10 можно изобразить еще одну структурную формулу:
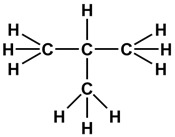
Следовательно, веществ состава С4Н10 должно быть два, каждому из этих веществ соответствует своя структурная формула. Если первое вещество называется бутаном или н -бутаном, то второе — изобутаном. Бутан и изобутан — изомеры, так как у них одинаковый количественный состав, но разный порядок соединения атомов. Подробно с явлением изомерии и изомерами можно познакомиться в теме «Виды изомерии».
Для пространственного отображения структуры молекул органических веществ используют стереохимические формулы.
Стереохимическая формула показывает пространственное расположение атомов в молекулах органических веществ.
Например, пространственное строение этана можно отобразить стереохимической формулой или с помощью проекций Ньюмена, отображающих конформации этана, то есть расположение (поворот) метильных радикалов относительно одинарной С–С-связи:
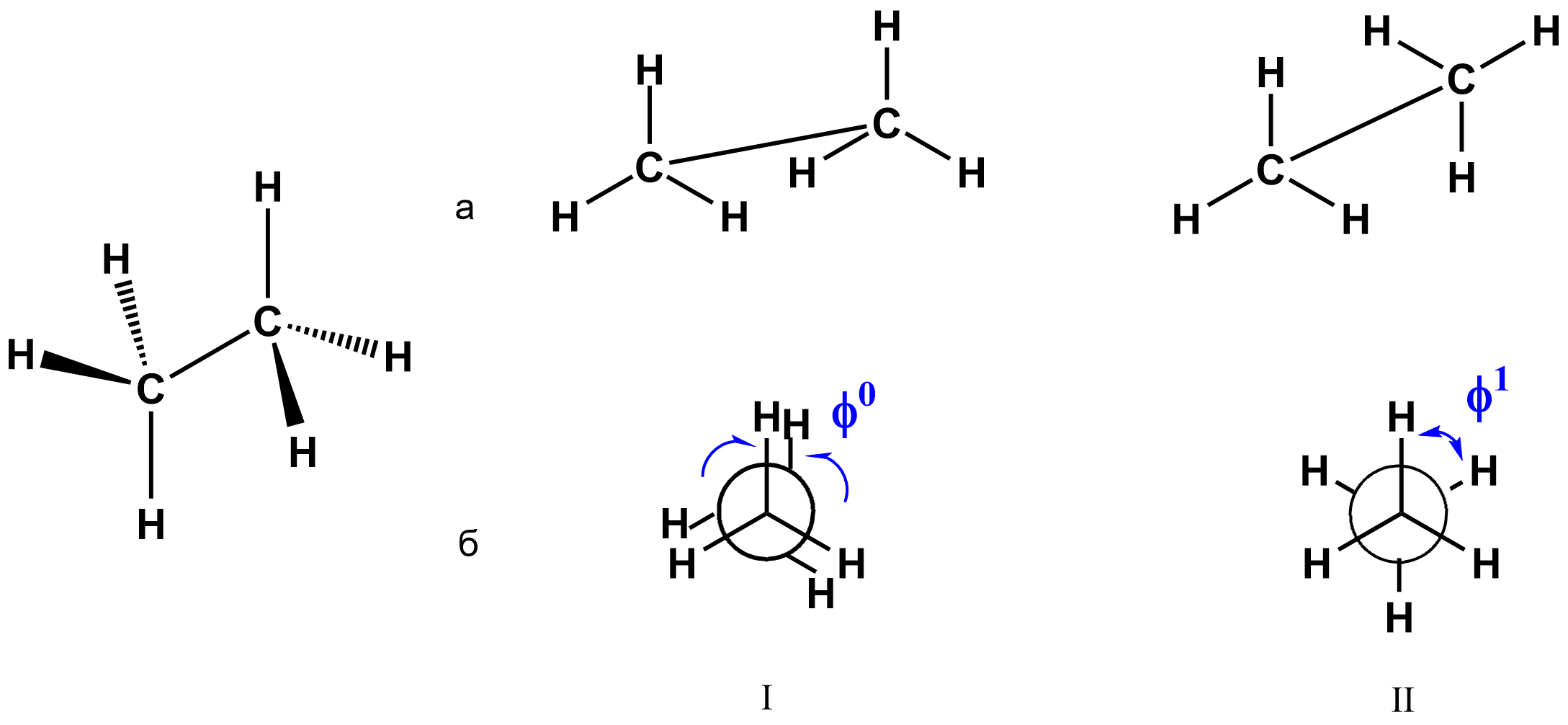
Более подробно проекции Ньюмена будут рассмотрены в теме «Виды изомерии».
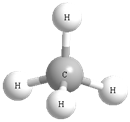
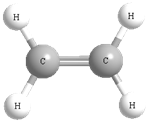
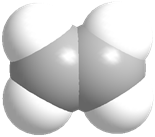
Для наглядности отображения пространственного строения органических молекул используют также разные модели. Наиболее распространенными являются шаростержневые модели, в которых атомы имеют форму шаров, а связи представлены в виде палочек. Одинарная связь — одна палочка, двойная связь — две палочки. Более достоверно истинную структуру молекул отображают масштабные (полусферические) модели: