Раздел 5. Взаимодействие полимеров с жидкостями и газами
Процессы взаимодействия полимеров с низкомолекулярными жидкостями играют важную роль в процессах формирования готовых изделий (например волокна из раствора), модификации свойств (пластификация) материала, а также в условиях эксплуатации этих изделий в различных жидких средах. Взаимодействие выражается в поглощении полимером жидкости и называется сорбцией. Если сорбция протекает в объеме полимерного материала, ее называют абсорбцией. Если поглощение происходит в поверхностных слоях, то процесс называют адсорбцией.
Сорбция
Механизм адсорбции обусловлен наличием сил поверхностного натяжения на границах раздела сред (рис. 5.1) вследствие различия в них сил межмолекулярного взаимодействия. Эти приводит к накоплению избыточной энергии на поверхности вещества, стремящегося втянуть свои поверхностные молекулы (молекулы адсорбента) и слабее взаимодействующие молекулы (молекулы адсорбтива) внутрь объема. Величина адсорбции в значительной степени зависит от удельной поверхности адсорбента. Численно адсорбция выражается количеством молей адсорбированного вещества на единицу массы адсорбента - x/m.
Изучение сорбции позволяет получать ценную информацию о структуре полимера, степени упаковки его молекул.
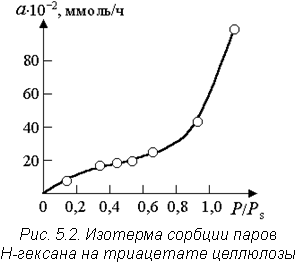
Обычно процессы сорбции описываются с помощью кривых зависимости количества адсорбированного вещества от концентрации (или давления) его в газовой фазе при постоянной температуре (изотермы сорбции, рис. 5.2.). Здесь величина Р / Р s - отношение упругости пара адсорбтива к упругости его насыщенного пара при данной температуре.
В области малых давлений паров выполняется линейный закон Генри:
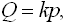
| (5.1) |
где 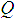 - степень заполнения поверхности адсорбента, p - давление адсорбтива, k - коэффициент пропорциональности. Эта зависимость на изотерме сорбции -гексана на триацетате целлюлозы (рис. 5.2) имеет место до значений Р / Р s = 0,3.
- степень заполнения поверхности адсорбента, p - давление адсорбтива, k - коэффициент пропорциональности. Эта зависимость на изотерме сорбции -гексана на триацетате целлюлозы (рис. 5.2) имеет место до значений Р / Р s = 0,3.
При больших давления мономолекулярная адсорбция на непористых адсорбентах описывается уравнением Лангмюра:
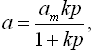
| (5.2) |
где а - количество адсорбированного вещества; am - предельная адсорбция, пропорциональная активной поверхности адсорбента; p - давление сорбата; k - константа адсорбции. На рис. 5.2 завершение мономолекулярной адсорбции определяется выходом изотермы сорбции на полочку в интервале относительных давлений 0,4 ÷ 0,5.
При наличии полимолекулярной адсорбции и конденсации на поверхности пористого адсорбента (Р / Р s > 0,6 на рис. 5.2) используют универсальное уравнение
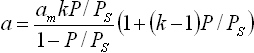
| (5.3) |
Термодинамика процесса адсорбции
Поскольку, как правило, межмолекулярное взаимодействие молекул адсорбтива менее интенсивно, чем адсорбента, адсорбция протекает с уменьшением свободной энергии поверхности (Δ F < 0) и выделением тепла (уменьшением энтальпии Δ Н < 0). При равновесии процессов адсорбции и десорбции Δ F = 0. Величина, рассчитанная в процессе адсорбции, характеризует количество и активность групп на поверхности адсорбента, способных реагировать с абсорбтивом. При адсорбции уменьшается и энтропия системы (Δ S < 0), поскольку молекулы абсорбтива ограничивают подвижность молекул полимера, уменьшая возможное число конформаций: Δ S = k ln (W 2 / W 1), где - постоянная Больцмана, W 2 и W 1 - термодинамическая вероятность конечного и начального состояния системы.