ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Система – совокупность тел, мысленно или фактически обособляемых из окружающей среды
Состояние системы характеризуется набором термодинамических параметров состояния: Т, р,V, С …
Процесс перехода из одного состояния в другое (Т = const – изотермический, p = const - изобарический, V = const - изохорический)
ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СОСТОЯНИЯ СИСТЕМЫ:
U-внутренняя энергия, H – энтальпия, S - энтропия, G – свободная энергия Гиббса,
F – энергия Гельмгольца
Функции состояния системы ( характеристические ф-ции ) свойства системы, значения которых однозначно определяются параметрами состояния. Изменение функций состояния не зависит от пути перехода системы из одного состояния в другое, а определяется лишь разностью значений функции в конечном и начальном состоянии. Величина функции зависит от количества или массы вещества.
U-внутренняя энергия - включает в себя все виды энергии системы (движения и взаимодействия молекул, атомов, ядер, электронов и др. частиц), кроме потенциальной и кинетической энергии движения всей системы как целого объекта. Абсолютное значение U определить невозможно, можно определить изменение ΔU= U2 – U1 с помощью работы (W) и теплоты (Q).
Работа ( W ) – количественная мера направленного движения частиц
Теплота ( Q ) – количественная мера хаотического движения частиц
Н=U+p·V - энтальпия, функция состояния системы, абсолютное значение определить невозможно, можно определить ΔH
Термохимия – часть термодинамики, изучающая тепловые эффекты процессов
Термохимические уравнения (указаны агрегатные состояния веществ и тепловой эффект
реакции, допустимы дробные стехиометрические коэффициенты)
пример Н2 (г) + ½О2 (г) = Н2О (ж); Δ r Hº298= -285,84 кДж
Эндотермическая реакция- реакция с поглощением теплоты, Δ r H > 0.
Экзотермическая реакция- реакция с выделением теплоты, Δ r H <0.
Закон Гесса: тепловой эффект процесса не зависит от пути его протекания (т.е. от числа промежуточных стадий и веществ), а определяется природой и физическим состоянием исходных веществ и продуктов реакции
1-ое следствие: тепловой эффект процесса можно рассчитать как разность суммарной энтальпии продуктов реакции и суммарной энтальпии исходных веществ
| Стандартное состояние вещества | |
| твёрдое вещество | Идеальное состояние при относительном давлении 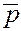 =1 =1
|
| жидкое вещество | |
| Газообразное вещество | Идеальный газ при парциальном относительном давлении 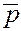 i =1 i =1
|
| Растворённое вещество | Идеальный раствор с концентрацией 1моль/л |
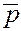 - относительное давление, равное отношению заданного давления к стандартному давлению
- относительное давление, равное отношению заданного давления к стандартному давлению 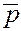 = р атм/1 атм= р кПа/100кПа = р Па/105 Па
= р атм/1 атм= р кПа/100кПа = р Па/105 Па
∆fHº i – стандартная энтальпия (теплота) образования
i –го вещества равна тепловому эффекту образования одного моля этого вещества из соответствующих простых веществ, если все участники реакции находятся в стандартных состояниях При этом энтальпии образования простых веществ, устойчивых в данных условиях, принимают равными нулю.
Тогда стандартная энтальпия реакции равна:
Δ rHºT = ∑ν i Δ fHºT,i продуктов - ∑ν j Δ fHºT,j исх. веществ
Стандартные энтальпии образования табулированы, как правило, при 298 К (Δ f Hº298)
Зависимость энтальпии реакции (в данном случае стандартной) от температуры в области 298 ÷ Т, в которой нет фазовых переходов, в интегральномвиде выражается уравнением Кирхгофа:
Δ r HºT = Δ r Hº298+ 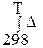 rcºpdT
rcºpdT
Где ∆ rcºp – изменение стандартной теплоемкости системы в ходе реакции, равное разности суммарной стандартной теплоемкости продуктов реакции и суммарной стандартной теплоемкости исходных веществ с учетом стехиометрических коэффициентов
Если ∆ rcºp=0, то Δ r HºT = Δ r Hº298
Если ∆ rcºp=const, то Δ r HºT = Δ r Hº298+ ∆rcºp(Т-298)
Энтропия S –функция состояния системы мера неупорядоченности состояния системы
S=R·lnW (W-термодинамическая вероятность системы, число возможных микросостояний, которыми можно реализовать данное макросотояние) [дж/моль·К]. Можно определить абсолютное значение (3-ий закон термодинамики- энтропия идеального кристалла при Т= 0 К равна 0). Энтропия увеличивается с ↑Т; Sг>Sж>Sт
Стандартную энтропию реакции при 298К, ∆rSº298 рассчитывают по формуле
∆rSº 298 =∑νiSº298, i продуктов - ∑ νjSº298,j исх веществ
Зависимость энтропии реакции от температуры в области 298 ÷Т, в которой нет фазовых переходов, в интегральном виде выражается уравнением:
∆rSº Т = ∆rSº 298 + 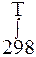 (∆ r cºp /Т)dT Если ∆ rcºp=0, то ∆ r SºT = ∆ r Sº298
(∆ r cºp /Т)dT Если ∆ rcºp=0, то ∆ r SºT = ∆ r Sº298
Если ∆rcºp=const, то ∆r SºT = ∆r Sº298+ ∆rcºp(lnТ-ln298)
Функциями состояния системы: энергия Гиббса: G=Н-T·S, и энергия Гельмгольца: F=U-T∙S
Критерий возможности самопроизвольного протекания реакции в прямом направлении в изобарно-изотермических условиях:∆rGТ=∆rНТ - Т∙∆rSТ < 0 Направление процесса определяется соотношением энтальпийного ∆rН и энтропийного Т∙∆rS факторов реакции
Критерий возможности самопроизвольного протекания реакции в прямом направлении в изохорно-изотермических условиях: ∆rFТ=∆rUТ - Т∙∆rSТ < 0
Соотношение между ∆rGТ и ∆rFТ: rGТ - ∆rFТ = ∆rНТ - ∆rUТ = р·∆V= ∆ν ·RT
Абсолютные значения G и F определить нельзя, для расчетов используют энергии образования веществ.
Энергией Гиббса образования вещества ∆f Gi называется энергия Гиббса реакции образования
1 моля i-го вещества из простых веществ, устойчивых в данных условиях.
Энергия Гиббса образования простых веществ, устойчивых в данных условиях, принимается равной нулю.
Если все вещества находятся в стандартном состоянии, то энергия Гиббса реакции образования вещества называется стандартной энергией Гиббса образования вещества ∆f Giº
Величины ∆f Giº 298 табулированы
Энергию Гиббса химической реакции можно рассчитать двумя способами
1) ∆r GT=∑νi∙ ∆f GT,i прод - ∑νi∙ ∆f GT,i исх.веществ
2) ∆r GT= ∆rНТ - Т∙∆rSТ
Если исходные вещества и продукты реакции находятся в стандартных состояниях, то по этим формулам рассчитывают стандартную энергию Гиббса реакции ∆r GºT. Связь между ∆r GT (при нестандартных состояниях веществ) и ∆r GºT (при стандартных)
для реакции: aA(г)+bB(г)+dD(к) = eE(г)+fF(г)
выражается уравнением изотермы Вант-Гоффа
∆r GT = ∆r GºT+ RTln (peE pfF / paA pbB)
_
где pi – относительное парциальное давлениесоответствующих газообразных компонентов реакции