В качестве причины гипертонии феохромоцитомы и вненадпочечниковые параганглиомы зачастую бывают пропущены, что связано с их редкой встречаемостью. Тем не менее, эти опухоли должны быть исключены при первичной диагностике гипертензии. Наиболее широко используемым методом является определение мочевой экскреции катехоламинов и их метаболитов, так же используется измерение уровня катехоламинов в плазме (1–3).
Предыдущие рекомендации о предпочтительных биохимических исследованииях при феохромоцитоме в большей степени основаны на эмпирическом опыте, чем на принципе доказательной медицины. В настоящий момент эти рекомендации пересматриваются в свете новых технических достижений и изменения патогенетического понимания метаболизма катехоламинов (4). В настоящий момент известно, что катехоламины внутри хромаффинных клеток метаболизируются в неактивные метилированные производные (адреналин в метанефрин, норадреналин в норметанефрин). Внутриопухолевый процесс метилирования катехоламинов происходит постоянно, и не зависит от времени выброса катехоламинов в сосудистое русло. Исследования, проведенные в соответствии с этой концепцией, показали, что фракционированное определение метанефринов (то есть раздельное определение метанефрина и норметанефрина) в моче или плазме обладает наибольшей диагностической чувствительностью по отношению к изначальному (т.е. истинному опухолевому) количеству катехоламинов (5–11).
Исходя из вышеуказанных исследований, основной рекомендацией, поддерживаемой ISP, является необходимость измерения фракционированных метилированных производных катехоламинов в плазме и/или моче (зависит от доступности теста). В настоящий момент отсутствует единое мнение о предпочтительности мочевого или плазменного определения уровня фракционированных метанефринов. Метанефрины плазмы определяются, как правило, в свободной форме (как и при продукции опухолью), тогда как мочевые фракции представлены конъюгированными сульфатными формами в результате реакции с желудочно-кишечными ферментами. Таким образом, уровень экскреции метанефринов определяется после деконъюгации. Это является объяснением того, что в некоторых исследованиях отмечают диагностические преимущества плазменного измерения по сравнению с мочевой экскрецией (8,11). Тем не менее, выявленные различия, несущественны по сравнению с преимуществами любого метода определения фракционированных метанефринов по отношению к ранее используемым методам определения катехоламинов. Гораздо важнее при выборе того или иного метода определения фракционированных метанефринов учитывать факторы, приведенные в Блоке 2.
Блок 2 Факторы, влияющие на выбор метода измерения фракционированных метанефринов при феохромоцитоме и парагангглиоме.
| Мочевые метанефрины | Свободные метанефрины плазмы |
| Определение уровня метанефринов выполняется после этапа деконъюгации, в значительной степени отражает уровень конъюгированных, а не свободных метаболитов | Отражают уровень свободных метаболитов, произведенных в опухоли |
| Хорошо изученный, широко используемый тест | Относительно новый метод с постоянно улучшаемыми характеристиками |
| Концентрация в моче (200-2000 нмоль/л) определяются относительно легко | Концентрация в плазме (0,1-0,5 нмоль/л) затруднительна для анализа |
| Наиболее простой метод для медицинского персонала | Забор крови требует опыта и усилий медицинского персонала |
| Сбор мочи в течение 24 часов обременителен для больного | Метод относительно удобен для пациентов |
| Возможны проблемы с определением суточного диуреза | Забор крови и определение концентрации достаточно надежны |
| Трудно оценить влияние функции симпато-адреналовой системы и диеты | Легко контролировать влияние симпатоадреналовой системы и диеты |
| У детей 24-часовой сбор мочи сложен, затруднительна интерпретация результатов суточной экскреции из-за отсутствия возрастных референсных значений | У детей забор крови связан со стрессом, однако результаты легче интерпретировать без принятых возрастных референсных значений |
| Проведение теста не используется у пациентов с ХПН | Метод может быть использован у больных с ХПН |
В результате обсуждения на сессии по биохимической диагностике выработаны две рекомендации:
- референсные значения для плазменных и мочевых фракционированных метанефринов должны прежде всего гарантировать оптимальную диагностическую чувствительность, специфичность теста оценивается во вторую очередь. Это объясняется опасностью смертельных последствий пропущенного диагноза;
- диагностический алгоритм не должен упрощаться однозначной интерпретацией метода (когда результат признается положительным или отрицательным). Необходимо использовать повторные исследования, опирающиеся на динамический характер гормональных показателей.
Последняя рекомендация базируется на признании того, что высокая чувствительность неизменно связана с ухудшением специфичности, значительно повышая число ложно-положительных результатов. Принятие серьезных лечебных решений должно базироваться на степени превышения верхней границы референсных значений. Незначительное превышение верхней границы нормальных значений как плазменных, так и мочевых фракционированных метанефринов связано с незначительной вероятностью феохромоцитомы, в то время как четырехкратное превышение ассоциируется с почти 100%-ой вероятностью опухоли (12). Фактический уровень повышения метилированных производных катехоламинов должен использоваться для определения показаний к дальнейшему топическому обследованию.
Общим мнением экспертов является необходимость дальнейшей топической диагностики при вероятности ложноположительного заключения. Тем не менее, отсутствует единое понимание о методах, которые стоит предпочесть. Несмотря на необходимость топического диагноза, необходимо рассмотреть возможные причины, повлиявшие на появление ложноположительного результата. Например, сидячее положение при заборе крови является фактором, повышающим вероятность ложноположительного результата, поэтому рекомендован забор крови в положении лежа.
ТОПИЧЕСКАЯ ДИАГНОСТИКА.
Группа экспертов ISP пришла к четкому заключению, что топическая диагностика феохромоцитомы или параганглиомы может быть начата только в случае клинической необходимости и обоснованного подозрения на хромаффинную опухоль. Если такие подозрения связаны с повышенным уровнем катехоламинов, то результаты должны значительно превышать нормальные значения. У пациентов с наследственным предрасположением или наличием феохромоцитомы в анамнезе - даже сомнительные результаты гормонального исследования являются показанием к топической диагностике.
В отношении топической диагностики являются важными следующие соображения:
· в результате изучения наследственной предрасположенности к феохромоцитоме и параганглиоме выявлены гены, являющиеся причиной заболевания (см. ниже), при их генетической верификации - установлены показания к ранней топической диагностике, которая позволяет выявлять опухоли, небольшие по размеру и в нетипичных местах;
· из-за широкого распространения методов топической диагностики - инциденталомы надпочечников стали клинической проблемой, при которой необходимо исключение хромаффинной природы опухоли независимо от клинических проявлений;
· понимание природы надпочечниковой и вненадпочечниковой локализации опухоли при различном генотипе и фенотипе обуславливает выбор определенного топического алгоритма обследования, что уменьшает необоснованные затраты, лучевую нагрузку и время, требуемое для выявления опухоли.
КТ и МРТ являются равноправными методами при выборе способа первичной диагностики, кроме детей, беременных и пациентов с аллергией.Общим мнением является то, что первичное исследование сосредоточено на брюшной полости и малом тазе. Если опухоль не найдена, то необходимо исследование грудной клетки и шеи. Необходимо понимать, что при такой тактике метастатическое поражение трубчатых костей может быть пропущено.
Несмотря на высокую чувствительность КТ и МРТ анатомический подход к топической диагностике неспецифичен, В некоторых наблюдениях крайне важна идентификация хромаффинной природы опухоли. В настоящее время наибольшая специфичность функциональной топической диагностики отмечена при применении сцинтиграфии метайодбензилгуанидином, меченным изотопом I123 (МИБГ- I123) (13,14). Группа экспертов пришла к единому мнению о несомненной пользе этого исследования, тем не менее остается дискутируемым вопрос о применении сцинтиграфии с МИБГ- I123 для всех опухолей и в последовательности его применения по отношению к КТ или МРТ.
Применение сцинтиграфии с МИБГ- I123 обосновано двумя основными позициями:
· возможность дифференциального диагноза феохромоцитомы и параганглиомы с опухолями иного происхождения;
· метод позволяет определить степень распространенности поражения (диагностика множественных опухолей и метастазов).
От выполнения сцинтиграфии с МИБГ- I123 можно воздержаться при выявленных опухолях надпочечника <5 см в диаметре, при которых отмечается существенное повышение уровня метанефрина в плазме или моче. Это объясняется тем, что небольшие опухоли редко метастазируют, а опухоли с преимущественной секрецией адреналина в подавляющем большинстве расположены в надпочечнике (15). Если после проведенного полноценного топического обследования остаются диагностические сомнения – в качестве дополнительного исследования может быть использован поэтажный забор крови и/или сравнительное определение уровня адреналина и норадреналина при суперселективной катетеризации надочечниковых вен.
Несмотря на преимущества сцинтиграфии с МИБГ- I123, ее чувствительность оставляет желать лучшего, особенно в диагностике метастатического поражения. В связи с этим используются другие методы функционального отображения. При проведении позитронно-эмиссионной томографии (ПЭТ) для диагностики феохромоцитомы используют новые многообещающие специфичные радионуклиды 6-[18F]-фтордопамин, [18F]-дигидроксифенилаланин (ДОФА), [11C]-гидроксиэфедрин, или [11C] - адреналин (16–21). Последние исследования продемонстрировали превосходство этих методов по сравнению с сцинтиграфией с МИБГ- I123 и МИБГ- I131 (17). В качестве методов первого ряда топической дикагностики не рекомендованы такие методы накопительной диагностики, как октреоскан и ПЭТ с [18F] фтордезоксиглюкозой (14,22). Эти варианты обследования могут применяться у больных с отрицательным результатом сцинтиграфии с МИБГ- I123, при быстро растущих опухолях, имеющих высокую метаболическую активность, или имеющих рецепторы к соматостатину (23,24).
ГЕНЕТИКА.
К настоящему моменту идентифицированы мутации пяти генов, которые обуславливают наследственные катехоламин-продуцирующие феохромоцитомы и параганглиомы:
· RET-протоонкоген, как причина синдромов множественной эндокринной неоплазии 2а и 2б типа (МЭН 2а и 2б);
· VHL-ген, мутации обуславливают синдром фон Хиппеля-Линдау;
· NF1-ген, мутации ассоциированы с болезнью фон Реклингхаузена (нейрофиброматоз I типа);
· SDHD и SDHB-гены, кодирующие экспрессию сукцинатдегидрогеназы, ее D и B субъединицы - связаны с семейными внесиндромными феохромоцитомами и параганглиомами (25–36). Мутация в шестом гене, кодирующим С субъединицу сукцинатдегидрогеназы (SDHC) обуславливает возникновение парасимпатических параганглиом (хемодектом).
В настоящее время рутинно проводимое генетическое исследование четырех из вышеуказанных генов (RET, VHL, SDHB, и SDHD) ярко продемонстрировало, что наследственная причина хромаффинных опухолей выявляется отнюдь не у 10 % пациентов, как представлялось ранее, а у значительно большего числа больных (15,37-39). Необходимо отметить, что у 7.5-27.0% опухолей без очевидного семейного синдрома или семейного анамнеза выявлены мутации в одном из этих четырех генов (таб. 1) (29,31,36,40,41). Наследственная предрасположенность при феохромоцитоме оценивается приблизительно в 20-30%. Высокая распространенность скрытых мутаций указывает на необходимость широкого использования генетического исследования у пациентов с хромаффинными опухолями. В настоящее время генотипирование при феохромоцитоме является стандартом диагностики.
Группа экспертов ISP пришла к общему заключению, что несмотря на необходимость генетического исследования при феохромоцитоме и параганглиоме, нецелесообразно его проведение по всему спектру возможных генетических нарушений у каждого пациента. Было подчеркнуто, что решение о характере генетического исследования принимается из клинических соображений. Некоторые факторы, влияющие на спектр генотипирования, отображены на рис.1.
Для того чтобы выделить потенциальную зону генетического исследования и получить согласие пациентов, группа экспертов подчеркнула важность полноценной клинической и анамнестической оценки ситуации, специализированной генетической консультации. Наличие у прямых родственников больного феохромоцитомой факта внезапной смерти вследствие недиагностированных прижизненно сердечно-сосудистых заболеваний увеличивает вероятность наследственного характера заболевания. В настоящее время считается, что, по крайней мере, 50% катехоламин-продуцирующих опухолей при жизни остаются недиагностированными. Клинические симптомы заболевания так же могут указывать на различные варианты генетического поражения (например, мутация VHL-гена при гемангиоматозе сетчатки).
Время манифестации опухолевых и гормональных проявления является важным фактором для генетически детерминированных феохромоцитом, так как наследственные феохромоцитомы и параганглиомы чаще, чем спорадические выявляются в молодом возрасте (31,32). По крайней мере, у 36% детей с феохромацитомами и параганглиомами выявляется генетическая причина болезни, что подчеркивают потенциальную важность генетического исследования в педиатрической практике при этом типе опухолей (42). У молодых пациентов со спорадическими опухолями (по клиническим данным) вероятность генетического поражения выше, чем у пожилых. Тем не менее, почтенный возраст пациента не исключает семейного характера заболевания. Например, описано наблюдение 73-летней женщины с клинически спорадической феохромоцитомой, у которой выявлена мутация, характерная для МЭН 2а, дальнейшее обследование выявило медуллярный рак щитовидной железы (43).
Группа экспертов выработала рекомендации, исходя из которых, целесообразно принять решение об исследовании конкретного гена. Такими факторами являются: локализация опухоли, наличие метастатического поражения, преимущественный тип опухолевой секреции. Исключения составляют больные с очевидными клиническими проявлениями семейных опухолей (например, медуллярный рак щитовидной железы у пациентов с МЭН 2 типа). Хотя SDHB и SDHD-мутации встречаются при солитарных опухолях надпочечниковой локализации, у пациентов с этим типом генетического поражения наиболее часто выявляются вненадпочечниковые параганглиомы и множественные опухоли (28,29,39–41,44). Исследование на SDHD и SDHB-мутации у пациентов с вненадпочечниковыми опухолями особенно актуальны. Это обусловлено более высоким злокачественным потенциалом при SDHB-мутации; наиболее вероятно выявление этого типа мутации у пациентов с вненадпочечниковой параганглиомой и наличием метастазов (рис. 1) (29,40,41).
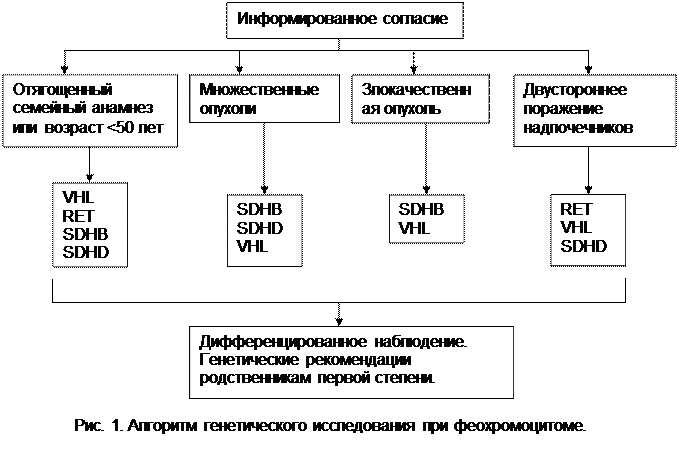
Таблица 1. Относительная частота генетических нарушений при спорадических (по клиническим данным) феохромоцитомах и параганглиомах в различных европейских странах.
| ГЕН | Страна и автор | |||
| Германия и Польша (39) | Голландия WNM Dinjens, персональное сообщение | Франция (40) | Испания М. Robledo персональное сообщение | |
| VHL | 4,4 | 3,5 | ||
| SDHB | 1,5 | |||
| SDHD | 1,6 | 0,8 | ||
| RET | 0,4 |
В то же время вненадпочечниковая локализация опухолей и злокачественные проявления практически не встречаются при синдромах МЭН 2 типа. Таким образом, при наличии этих симптомов исследование на RET- мутацию будет нецелесообразно. Кроме того, феохромоцитомы у больных с МЭН 2 типа всегда производят адреналин, в связи с этим отсутствует необходимость исследования на RET-мутацию при изолированном повышении плазменного или мочевого норметанефрина (45). В отличие от феохромоцитомы при МЭН 2 типа опухоль при VHL-синдроме не производит существенные количества адреналина. Исследование на VHL-мутацию является необоснованным при изолированном повышении метанефрина в плазме или моче (45).
ВЕДЕНИЕ ПАЦИЕНТОВ.
Правильное ведение пациентов с феохромоцитомой основано на тесном сотрудничестве различных специалистов (38,46–49). В большинстве наблюдений успешным признано оперативное лечение. Даже если клиническое течение феохромоцитомы было бессимптомным, высокий уровень циркулирующих катехоламинов во время операции приводит к гипертензивным кризам, аритмиям. В связи с этим рекомендуется всем пациентам с биохимически подтвержденной феохромоцитомой и параганглииомой проводить предоперационную подготовку, целью которой является нивелирование воздействия циркулирующих катехоламинов.
Из-за того, что существуют неравнозначные подходы в оценке эффективности терапии, различия методик применения лекарственных средств, группа экспертов не смогла выработать единые рекомендации о предпочтительном препарате для дооперационной α-блокады; среди рекомендованных групп препаратов антагонисты α-адренорецепторов (46,47,49), блокаторы кальциевых каналов и блокаторы ангиотензиновых рецепторов (50). При тахиаритмиях рекомендованы блокаторы β-адренорецепторов и блокаторы кальциевых каналов (46). Отдельно подчеркнуто, что использование β-адреноблокаторов возможно только после адекватной предварительной α-адреноблокады. Рекомендовано увеличение объема циркулирующей жидкости до и после оперативного лечения.
Необходимо, чтобы операцию выполнял хирург, обладающий опытом подобных вмешательств: только специалист, понимающий биологический характер хромаффинных новообразований понимает насколько важно учитывать тип, локализацию, размер и наследственный фон опухоли (51). При первичном вмешательстве, при множественных брюшных феохромоцитомах и параганглиомах небольшого размера эндоскопическая адреналэктомия признается методом выбора (52). В настоящее время опухоли до 10 см могут быть удалены лапароскопически. При наследственном варианте опухолей, когда существует высокая вероятность двустороннего поражения, считается возможным выполнение органосохраняющих операций с оставлением коры надпочечника, однако необходимо понимать, что такой объем операции сопряжен со значительным возрастанием риска местного рецидива опухоли (53-56).
Все специалисты согласились с необходимостью биохимического тестирования через 2 недели с момента операции для подтверждения адекватности лечения. Тем не менее, отмечено, что нормальные послеоперационные показатели не исключают наличия незначительного количества хромаффинной ткани, которая приведет к рецидиву заболевания. В связи с этим фактом, сообщение пациентам о полном выздоровлении признано неоправданным.
Ранжированность послеоперационного наблюдения остается значительной проблемой. Наблюдение является особенно важным для пациентов с характерными мутациями. В настоящее время ни один из существующих методов исследования удаленного материала не позволяет исключить потенциал злокачественного развития болезни или рецидив опухоли. В связи с вышесказанным, отдаленное периодическое наблюдение считается обязательным для всех случаев феохромоцитомы и параганглиомы.
МОРФОЛОГИЯ.
Задачей патоморфологического исследования является дифференциация первичных феохромоцитомы и параганглиомы и их метастазов от другой эндокринной и неэндокринной опухоли, а также выявление особенностей строения опухоли, повышающих вероятность злокачественного развития или наследственного характера болезни. Такими факторами могут быть мультицентричность, сопутствующая гиперплазиия мозгового слоя, или морфологические результаты, ассоциированные с VHL-синдромом (57); к сожалению, такие данные можно выявить не всегда.
Для оптимальной информативности, заключение морфологического исследования должно содержать стандартные элементы. По критериям ВОЗ, опубликованным в 2004 году (58) злокачественное строение опухоли из хромаффинной ткани определяется наличием метастазов, а не местной инвазией. Даже обширная инвазия является неотчетливым показателем возможного метастазирования, в то же время инкапсулированные опухоли не исключают появления отдаленных отсевов. Таким образом, в сообщениях о морфологических типах феохромоцитом и параганглиом выделяют два типа агрессивного поведения опухолей, которые обусловлены различным биологическими характеристиками и требуют разных лечебных подходов.
Капсулярная и сосудистая инвазия, клеточная атипия, сходство с детской нейробластомой – ни один из перечисленных гистологических признаков, рассмотренный отдельно, не способен определить метастатический потенциал опухоли; тем не менее, многофакторный анализ может помочь идентифицировать опухоли со значительным риском метастазирования. Были предложены несколько вариантов комплексной оценки опухолевого роста, исходя из данных об инвазии, гистологической структуры, цитологических особенностей, митотической активности и других характеристик (59-61). Одно из исследований (59) определяет метастатический потенциал и клиническое течение болезни только у пациентов с имеющимися метастазами. Исследование Linnoila etal. (60) продемонстрировало, что более 70 % злокачественных симпатоадреналовых параганглиом могут быть выявлены на основании четырех факторов: вненадпочечниковая локализация, неровность контуров и неоднородность узла, наличие сливных некрозов и отсутствие гиалиновых включений. К сожалению, остальные сообщения не делают различий между внутринадпочечными и вненадпочечниковыми опухолями, что значительно снижает прогностическую ценность этих работ в отношении злокачественного роста. В некоторых исследованиях прослеживается корреляция между большим размером опухоли (> 5 см) и вероятностью метастатического поражения, однако как самостоятельный критерий злокачественности размер опухоли не может использоваться (15,59-61). В настоящее время консенсус о формальной оценочной шкале злокачественности не достигнут, тем не менее, существуют принятые критерии злокачественности в отдельных патоморфологических ассоциациях. Обычно в шкалу включают основные и дополнительные критерии. Прогнозирование потенциально неблагоприятных результатов лечения определяет необходимость наблюдения, тем не менее характер такого наблюдения остается неясным.
Ассоциация руководителей анатомической и хирургической патологии (ADASP) наблюдает за стандартизацией патологии в США. Рекомендации ADASP,сообщения об основных типах опухоли доступны в журналах патологии, в учебниках (62) и на вебсайте организации (63). С целью унификации работы онкологических учреждений недавно были обновлены протоколы для надпочечниковых (64) и и вненадпочечниковых параганглиом (62). В Великобритании, Королевский Колледж Патологов недавно выпустил детализированный морфологический протокол (65), в основном опирающийся на сообщении Linnoila и al. (60).
В настоящее время морфологи опираются, главным образом, на интерпретацию обычных гистологических срезов с применением окраски гематоксилином-эозином. Дополнительное использование иммуногистохимии необходимо для дифференциального диагноза. Также метод используется в качестве вспомогательного для оценки злокачественного потенциала, однако результаты противоречивы (66). Определение маркера пролиферации Ki-67 в парафиновых срезах с использованием моноклональных антител MIB-1, является наиболее коррелирующим показателем злокачественности (67). Метод недавно предложен в качестве наиболее предпочительного (59). Тем не менее, исследования с применением MIB-1 отличаются методологическими противоречиями, что не позволяет рекомендовать его для повсеместного применения. Иммунногистохимическое исследование с маркированием антител Ki-67 маркировка дает полезную информацию о злокачественности опухоли в качестве дополнительного аргумента, но в настоящее время зависит от качества выполнения методики.