В зависимости от количества нефтепродукта, его вязкости, требуемой точности определения, отводимого для анализа времени, получили распространение три основных метода определения плотности:
а) ареометрический – определение плотности с помощью денсиметров (ареометров), градуировка которых отнесена к плотности воды при 4 °С и показания соответствуют r t 4. Точность измерения – 0,001 для маловязких и 0,005– для вязких нефтепродуктов. Если нефтепродукт очень вязкий, то его разбавляют равным объёмом керосина, измеряют плотность смеси и подсчитывают плотность самого продукта по формуле:
ρ = 2 ρсм – ρкеросина. (2.18)
б) метод уравнивания плотности или метод взвешенной капли – используется при малом количестве нефтепродукта, или для определения плотности твердых нефтепродуктов. По данному методу каплю нефтепродукта или кусочек парафина вводят в раствор (водно-соляной или водно-спиртовый) и, увеличивая (добавляя соль) или уменьшая (добавляя спирт) плотность раствора добиваются, чтобы нефтепродукт перешел во взвешенное состояние. В этом случае ρп–та = ρраствора, и, измерив плотность раствора любым методом, получают плотность анализируемого вещества.
в) пикнометрический – определение плотности с помощью специальных сосудов – пикнометров. Точность измерения зависит лишь от точности взвешивания, поэтому может быть очень большой (до 0,00005). Метод применяется в научных исследованиях. В частности, данный метод измерения плотности используется при определении структурно группового состава нефтепродуктов по методу n-d-M (n -ρ- M).
В зависимости от количества нефтепродукта и требуемой точности применяют пикнометры разной формы и емкости (от 1 до 100 мл).
Характеристический фактор
Эту величину называют еще фактором парафинистости нефтепродукта, т.к. чем выше содержание парафиновых углеводородов (меньше ароматических), тем больше величина этого показателя. Этот параметр позволяет судить о химической природе, происхождении и качестве нефти и нефтепродуктов и является функцией плотности. Вычисляется по формуле:
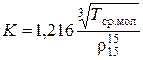 , (2.19)
, (2.19)
где Т ср.мол – абсолютная среднемольная температура кипения фракции, К.
Величину t ср. мол можно определить по формуле:
 , (2.20)
, (2.20)
где ti – температуры кипения отдельных компонентов смеси, °С;
Ni – количество молей компонентов смеси.
Для узких фракций (10–20 °С) t ср.мол можно принять равной t 50 отгона по ГОСТ, (или принять t ср.объем равной 50 % отгона по ИТК).
Для парафинистых нефтей K = 12,5–13, для нефтено-ароматических
K = 10–11, для ароматических – менее 10.
Молекулярная масса
Молекулярная масса – безразмерная величина, равная отношению массы молекулы вещества к 1/12 массы атома изотопа 12С. Несмотря на то что значение молекулярной массы не имеет размерности, в некоторые уравнения данный параметр входит с размерностью кг/кмоль (г/моль) для сохранения размерности рассчитываемой величины.
Для нефти и даже ее узких фракций понятие молекулярной массы в строгом его значении неприменимо, т.к. фракции нефти состоят из сотен различных углеводородов. В то же время молекулярная масса является важнейшей характеристикой химических веществ, и поэтому для нефти и ее фракций пользуются величиной «средняя молекулярная масса», опуская при этом слово «средняя».
Молекулярная масса широко используется в технологических расчетах, при определении химического состава узких нефтяных фракций. Между температурой кипения и молекулярной массой существует прямо пропорциональная зависимость.
Молекулярную массу нефтепродуктов можно определять экспериментально – криоскопическим или эбуллиоскопическим методом. Экспериментальное определение молекулярной массы нефтяных фракций основано на правиле Рауля-Вант-Гоффа о прямой пропорциональности осмотического давления и мольной концентрации вещества в растворе. Осмотическое давление, в свою очередь, находится в прямой зависимости от таких величин как понижение точки замерзания раствора (как правило, раствора в бензоле или нафталине) – криоскопический метод, или повышения точки его кипения (эбуллиоскопический метод).
Рассчитывают молекулярную массу и по эмпирическим формулам, в частности, по формуле Воинова:
M = a + bt + ct 2, (2.21)
где t – средняя молекулярная температура кипения фракции, °С;
a, b, c – коэффициенты, значение которых зависит от химической природы нефтепродукта (его характеристического фактора; в частности, при К = 10, a = 56, b = 0,23, c = 0,0008; при К = 12,
a = 69, b = 0,18, c = 0,0014 и т.д.) [5, стр. 9; 7, рис. 3.1–3.5 и
табл. 3.1].
Так, для парафиновых углеводородов формула имеет следующий вид (точность 3–5 %):
M = 60 + 0,3 t + 0,001 t 2. (2.22)
Формула Воинова была уточнена Эйгенсоном, который ввел в нее характеристический фактор:
M = (7 К – 21,5) + (0,76 – 0,04 К) t ср.мол + (0,0003 К – 0,00245) t 2ср.мол (2.23)
где К – характеристический фактор;
t ср.мол – средняя молекулярная температура кипения фракции, °С.
Точность расчетов по данной формуле 2–3 %. Она применима для фракций, выкипающих до 350 °С.
Для ориентированного расчета M могут также использоваться следующие формулы:
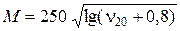 ; (2.24)
; (2.24)
 ; (2.25)
; (2.25)
 , (2.26)
, (2.26)
где n20 и n50 – кинематические вязкости узких фракций при 20 и 50 °С соответственно, мм2/с (сСт);
 – относительная плотность.
– относительная плотность.
Формула БашНИИНП:
M = (160 – 5 К) – 0,075 t ср.мол+ 0,000156 Кt 2ср.мол, (2.27)
где К – характеристический фактор;
t ср.мол – среднемольная температура кипения фракции, °С.
Формула расчета молекулярной массы через показатель преломления:
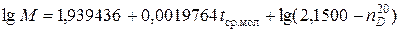 , (2.28)
, (2.28)
где 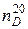 – коэффициент преломления.
– коэффициент преломления.
Формула Крэга:
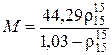 , (2.29)
, (2.29)
где 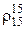 – относительная плотность.
– относительная плотность.
Молекулярную массу можно определить также по графикам и номограммам [1, рис. 3.3; 3, ПР6; 7, рис. 3.1–3.5 и табл. 3.1].
Молекулярная масса величина аддитивная. Поэтому среднюю молекулярную массу смеси можно определить по уравнениям:
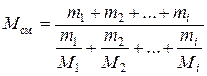 (2.30)
(2.30)
или 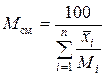 , (2.31)
, (2.31)
где Mi – молекулярная масса i -го компонента;
mi –масса i -го компонента;
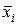 – содержание i -го компонента смеси, мас. %.
– содержание i -го компонента смеси, мас. %.
 , (2.32)
, (2.32)
где xi – содержание i -го компонента в смеси, мольная доля.
В практике технологических расчетов часто требуется иметь мольный объем нефтепродукта (м3/кмоль), который для жидких нефтепродуктов вычисляется по формуле:
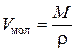 , (2.33)
, (2.33)
где М – молекулярная масса, кг/кмоль;
r – плотность, кг/м3.
Для расчета мольного объема паров используют уравнение Клапейрона:
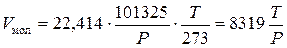 , (2.34)
, (2.34)
где P – давление в системе, Па;
T – температура системы, К.