Под давлением насыщенных паров понимают давление, развиваемое парами при данной температуре в условиях равновесия с жидкостью. Этот показатель характеризует испаряемость нефтепродуктов.
Если это давление равно давлению системы, то соответствующая температура, при которой это равенство имеет место, называется температурой кипения вещества.
В практике очень часто возникает задача пересчета давления насыщенных паров с одной температуры на другую. Для этих целей используют как эмпирические формулы, так и графики и номограммы.
Из графических методов наиболее распространен график Кокса, построенный для индивидуальных углеводородов (парафиновых). В то же время, он может с успехом применяться в технологических расчетах и для узких нефтяных фракций [1, рис. 3.7; 3, ПР7; 6, рис. 4; 7, рис. 7.1].
В технологических расчетах широко применяются также номограммы для пересчета температур кипения нефтепродукта с глубокого вакуума на атмосферное давление. Хорошую сходимость дает, в частности, диаграмма UОР [1, рис. 3.8; 3, ПР8; 6, рис. 5; 7, рис. 7.4].
Для пересчета давления насыщенных паров узких нефтяных фракций на различные температуры часто используют формулу Ашворта:
 , (2.35)
, (2.35)
где P нас, Т – давление насыщенных паров при температуре Т, Па;
T – температура в системе, К;
Т кип – температура кипения фракции при атмосферном давлении, К;
f (T) – функция температуры, которая выражается уравнением:
 . (2.36)
. (2.36)
Значения f (T) приведены в справочной литературе [3, ПР9; 7, табл. 7.2].
Для определения давления насыщенных паров (в кПа) узких фракций светлых нефтепродуктов при стандартной температуре (стандартная температура определения давления насыщенных паров – 37,8 °С или 100 °F) используют следующее уравнение:
 , (2.37)
, (2.37)
где 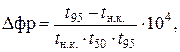 (2.38)
(2.38)
где t н.к., t 50, t 95 – температуры начала кипения фракции, выкипания 50 % объема и выкипания 95 % объема фракции соответственно, °С.
Эта формула позволяет рассчитать Р нас, 38 по характерным температурам кипения фракций. Для товарных бензинов Dфр лежит в пределах 1,5–2,5.
Давление насыщенных паров в значительной степени зависит от состава жидкой и паровой фаз. Для растворов и смесей, подчиняющихся законам Рауля-Дальтона, общее давление насыщенных паров вычисляется по формуле:
 , (2.39)
, (2.39)
где Р нас, i – давление насыщенных паров i -го компонента смеси при заданной температуре;
xi – мольная доля i -го компонента смеси.
При высоких давлениях реальные газы не подчиняются законам Рауля-Дальтона и найденные значения P нас уточняют с помощью критических параметров, фактора сжимаемости и летучести.
Критические параметры
Состояние реальных газов и паров характеризуется уравнением Ван-дер-Ваальса:
 (2.40)
(2.40)
где P – давление в системе, атм;
a /n2 – поправка на взаимное притяжение молекул, действующее как дополнительное давление, сжимающее газ (внутреннее давление);
V – объем системы, л;
b – поправка на внутренний объем молекул, л/моль;
R – универсальная газовая постоянная (R = 8,3148 Дж/моль×К);
T – температура, К.
Из уравнения следует, что до некоторого значения температуры газ можно превратить в жидкость, повышая его давление. Однако для каждого газа существует такая температура, при которой газ никаким повышением давления не может быть переведен в жидкость. Эта температура называется критической (t кр), а соответствующие ей давление и объем также называются критическими (P кр) и (V кр).
При повышении температуры до критической притяжение между молекулами жидкости падает до нуля. Соответственно, в критической точке исчезает различие между газообразной и жидкой фазами, и вещество может находиться только в газообразном состоянии.
Значение критических параметров для индивидуальных веществ приведены в справочниках [4, табл. 2.1; 7, табл. 11.1]. Для нефтяных фракций их определяют по номограммам и эмпирическим формулам:
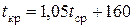 (для алифатических углеводородов); (2.41)
(для алифатических углеводородов); (2.41)
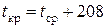 (для ароматических углеводородов), (2.42)
(для ароматических углеводородов), (2.42)
где t ср – средняя температура кипения фракции (для узкой фракции можно взять t 50 отгона по ГОСТ), °С.
 (в Па), (2.43)
(в Па), (2.43)
где M – молекулярная масса;
А – коэффициент, который можно рассчитать по формуле:
 (2.44)
(2.44)
где t 70 и t 10 – температуры 70 % и 10 % отгона фракции по ГОСТ.
Коэффициент А имеет значения в пределах 5–5,3 для парафиновых;
6 для нафтеновых; 6,5–7 для ароматических углеводородов; 6,3–6,4 для нефтепродуктов прямой перегонки; 6,8–7 для керосинов.
Значение Т кр – можно вычислить по формуле:
 (2.45)
(2.45)
где  , (2.46)
, (2.46)
где Т ср.мол – средняя молекулярная температура кипения, K;
 – относительная плотность.
– относительная плотность.
Значения критических параметров можно определять также по графикам и номограммам [1, рис. 3.9; 3, рис. 2–6; 4, рис. 2.19 и 2.20; 6, рис. 6;
7, рис. 4.1–4.7].
Если входящие в уравнение Ван-дер-Ваальса величины выразить через соответствующие критические параметры, то получим так называемые приведенные величины, которые используются в технологических расчетах для входа в номограммы при определении целого ряда величин – фактора сжимаемости, энтальпии и др.
 ; (2.47)
; (2.47)
 ; (2.48)
; (2.48)
 . (2.49)
. (2.49)
Фактор сжимаемости
Если в уравнении Ван-дер-Ваальса вместо P, T, и V вставить критические параметры, а значения констант заменить соответствующими выражениями также через критические параметры ( и
и  ), то для критической точки уравнение примет вид:
), то для критической точки уравнение примет вид:
 , (2.50)
, (2.50)
а для всех остальных условий будет иметь следующий вид:
PV = μ RT, (2.51)
где μ – фактор сжимаемости.
Фактор сжимаемости зависит от температуры, давления, природы нефтяных газов и позволяет учесть отклонение в поведении реального газа от идеального (для идеального газа пренебрегают размерами молекул и притяжением между ними) при повышенных температурах и давлениях.
Значение μ определяют графически, используя значения Р пр и Т пр
[1, рис. 3.10; 3, рис. 7; 4, рис. 2.21; 6, рис. 7; 7, рис. 5.1–5.3].
Фактор сжимаемости – величина аддитивная, и для смеси может быть определен по формуле:
 (2.52)
(2.52)
где m i – фактор сжимаемости i-го компонента смеси;
Ni – количество молей i-го компонента смеси.