РАЗДЕЛ I. Углеводороды
Алканы
Алканы относятся к предельным углеводородам, состав которых выражается общей формулой CnH2n+2. Основной тип их реакционной способности – реакции замещения.
Галогенирование алканов
Галогенирование алканов протекает под действием света. В реакциях хлорирования или бромирования алканов наблюдается избирательность замещения, а именно:
легче всего замещение протекает у третичного атома углерода, хуже – у вторичного и еще труднее – у первичного.
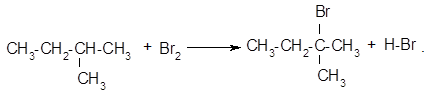 .
.
Образующиеся продукты называются галогеналканами (хлор- или бромпроизводные).
Нитрование (реакция Коновалова)
Алканы взаимодействуют с pазбавленной азотной кислотой пpи нагpевании и под давлением (реакция Коновалова). В результате происходит замещение атома водоpода на нитpогpуппу -NO2. Эту pеакцию называют pеакцией нитpования алканов, а пpодукты pеакции – нитpосоединениями, или нитроалканами.

Нитрование алканов подчиняется тем же закономерностям, что и галогенирование (легче замещается водород при третичном, затем – при вторичном, еще медленнее – при первичном атомах углерода.
Алкены
Алкены относятся к непредельным углеводородам, содержащим одну двойную связь. Состав алкенов выражается общей формулой CnH2n.
Реакционная способность алкенов определяется прежде всего наличием в их молекулах связи С=С, которая значительно активнее одинарных связей С-С и С-Н. Поэтому алкены более реакционноспособны по сравнению с алканами. Основной тип реакционной способности алкенов – реакции присодинения. Эти реакции сопровождаются разрывом π-связи с образованием насыщенных производных.
Галогенирование
Галогенирование (например, хлорирование или бромирование) проводят, действуя на алкены хлором или растворами брома. При этом в случае бромирования, по мере ее протекания, исчезает желто-коричневая окраска брома и образуется прозрачный раствор. Это качественная реакция на кратную связь.

Гидрогалогенирование и гидратация
Присоединение галогеноводородов (гидрогалогенирование) и воды (гидратация) к алкенам несимметричного строения идет региоселективно по правилу Марковникова: в реакциях присоединения полярных молекул НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т. е. к атому углерода, связанному с наибольшим числом атомов водорода).

При гидрогалогенировании образуются галогеналканы, а при гидратации – спирты. Реакция присоединения воды к алкенам происходит в присутствии минеральной кислоты (донора протонов) по механизму электрофильного присоединения.
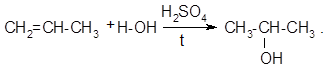
Окисление алкенов
При мягком окислении алкенов разрывается π-связь, а при жестком – и π-, и σ-связи. Поэтому строение продуктов окисления алкенов зависит от условий реакции и природы окислителя.
1. Мягкое окисление алкенов водным раствором перманганата калия (реакция Вагнера) приводит к образованию гликолей – двухатомных спиртов с соседним расположением гидроксильных групп:
3СН2=СН2 + 2KMnO4 + 4H2O → 3HОCH2CH2OH + 2KOH + 2MnO2 ↓.
В ходе реакции Вагнера происходит обесцвечивание фиолетовой окраски раствора KMnO4 и выпадение бурого осадка MnO2. Поэтому она служит качественной реакцией на кратную связь (проба Байера).
2. Жесткое окисление
При жестком окислении алкенов кипящим концентрированным раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:

Алкины
Алкины (ацетиленовые углеводороды) – непредельные углеводороды, содержащие тройную связь, общей формулой CnH2n-2. Для алкинов так же, как и для алкенов, характерны реакции присоединения, сопровождающиеся разрывом одной или двух π-связей.
3.1. Реакции присоединения
Галогенирование
Присоединение галогенов к алкинам протекает медленнее, чем в случае алкенов (первая π-связь разрывается труднее, чем вторая):

Гидрогалогенирование
Присоединение галогеноводородов идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам образуются по правилу Марковникова:

Гидратация (реакция Кучерова)
Присоединение воды к ацетилену происходит в присутствии соли ртути (II) в качестве катализатора. Реакция идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид:

При гидратации гомологов ацетилена образуются кетоны:

3.2. Кислотные свойства алкинов
Ацетилен и его гомологи с концевой тройной связью R-C≡C-H (алкины-1) вследствие полярности связи С(sp)-Н проявляют слабые кислотные свойства и способны отщеплять протон под действием достаточно сильных оснований. Подвижный атом водорода может замещаться на металл с образованием солей – ацетиленидов, например:

При взаимодействии ацетилена или алкинов-1 с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:

Образование белого осадка ацетиленида серебра (или красно-коричневого ацетиленида меди) служит качественной реакцией на концевую (терминальную) тройную связь. Если тройная связь находится не на конце цепи (нет подвижного атома водорода), то кислотные свойства отсутствуют и ацетилениды не образуются.
В сухом состоянии ацетилениды тяжелых металлов чувствительны к удару и легко взрываются. Их разлагают, пока они еще влажные, действием сильных минеральных кислот.

Алкадиены
К алкадиенам относят углеводороды, содержащие две двойные связи. Общая формула гомологического ряда алкадиенов CnH2n-2. В целом для них возможны те же реакции, что и для алкенов, например, реакции присоединения.
Галогенирование
Реакции присоединения к алкадиенам протекают по двум возможным направлениям, а именно как 1,4- и 1,2-присоединение. Следует отметить, что в случае 1,4-присоединения кратная связь перемещается в центр молекулы, то есть во второе положение и получается 1,4-дибромбутен-2.

Гидрогалогенирование
Данный тип реакции, как и галогенирование, может протекать по типу 1,2- и 1,4-присоединения. При 1,2-присоединении реакция подчиняется правилу Марковникова: атом водорода присоединяется к наиболее гидрированному атому углерода.
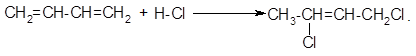
Циклоалканы
Реакционная способность циклоалканов зависит от размера цикла.
Малые циклы (циклопропан и циклобутан) являются непрочными и поэтому склонны к реакциям присоединения (гидрирование, галогенирование, гидрогалогенирование) с раскрытием углеводородного кольца.
Гидрирование

Циклопропан пропан
Галогенирование
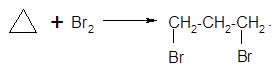
Циклопропан 1,3-дибромпропан
Гидрогалогенирование

Циклобутан 1-бромбутан
Средние циклы (циклопентан и циклогексан) относятся к прочным циклам и поэтому не склонны к реакциям присоединения, а вступают в реакции замещения (подобно алканам).
Легче всего реакция протекает у третичного атома углерода, труднее – у вторичного, хуже всего – у первичного.
Галогенирование

Циклопентан хлорциклопентан
Нитрование

Циклогексан нитроциклогексан
Арены
Арены, или ароматические (бензоидные) углеводороды, – это соединения, молекулы которых содержат, в частности бензольные кольца с замкнутой системой сопряженных связей.
Представители аренов:

Вследствие повышенной устойчивости бензольного кольца арены с трудом вступают в реакции присоединения или окисления, Для них наиболее характерны реакции замещения атомов водорода, связанных с циклом.
6.1. Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии AlCl3, или FeBr3 в качестве катализатора.
Схема реакции хлорирования бензола:

6.2. Нитрование
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот). Схема реакции:

Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование, образование гомологов бензола) происходит под действием а лкилгалогенидов (реакция Фриделя – Крафтса) в присутствии катализаторов – галогенидов алюминия или железа:

Ацилирование
Для введения ацильной группы RC=O по Фриделю–Крафтсу в качестве ацилирующих агентов используют ангидриды или хлорангидриды карбоновых кислот (ацилхлориды) R-CO-Cl. Реакция идет в присутствии безводного хлорида алюминия:
