Задача 1. Для реакции N2O4 → 2 NO2 при 55 ºС КР′ = 1,38 * 105 Н/м2. Сколько молей N2O4 следует поместить в сосуд ёмкостью 10 л для того, чтобы при равновесии концентрация NO2 в нём составила 0,1 моль/л.
По определению константа 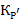 есть:
есть:

Преобразуем по уравнению Менделеева-Клапейрона:

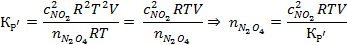
Подставим значения, предварительно переведя значения величин в единицы системы СИ
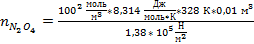 = 1,98 моль
= 1,98 моль
Ответ: 1,98 моль.
Задача 2. При смешении 1 кмоль А и 1 кмоль В в результате реакции А + 2В → АВ2 в равновесной смеси образовалось 0,2 кмоль АВ2. Определить численное значение КР при общем давлении 1 атмосфера если все вещества находятся в идеальном газообразном состоянии.
Поскольку в этой задачи даны моли веществ, проще всего будет рассчитывать КР через Кn. Тогда:

Исходя из стехиометрии легко рассчитаем равновесное количество участников реакции:

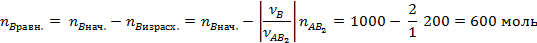

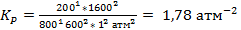
Ответ: 1,78 атм-2
1. Константа равновесия реакции Н2 + I2 → 2HI при 717 К равна 46,7. Определить количество (в молях) разложившегося HI при нагревании 1 моль HI до 717 К.
Ответ: 0,2264 моля.
2. Железо и водяной пар реагируют по уравнению Fe + H2O → FeO + H2. При 1000 К и 1,013 * 105 Па парциальное давление водорода составляет PH2 = 6,526 * 104 Па. Вычислите константу равновесия.
Ответ: 1,809
3. Вычислить константу диссоциации BaO по реакции BaO →Ba + ½ O2 при 4000 К, если известны константы реакций:
BaO → Ba + O; K1 = 0,0156
O2 → 2O; K2 = 2,1892
Ответ: 1,055 * 10-2.
4. Константа равновесия реакции Fe3O4 + CO → FeO + CO2 при 600 ºС равна 1,15. Определите конечный состав системы, если изначально в системе присутствовали 1 моль Fe3O4, 2 моль CO, 0,5 молей FeO и 0,3 моля CO2 при общем давлении 5 атм.
Ответ: 0,07 моль Fe3O4; 1,07 моль CO; 3,29 моль FeO; 1,23 моль CO2.
5. Для реакции CO + H2O↑ → H2 + CO2
lgKa = 2486/T + 1,565lgT – 0,066 * 10-3 T – 6,93.
Вывести уравнения ∆Hº; ∆Sº; ∆Gº; ∆cPº = f (T) и вычислить значения этих величин при 400 К.
Ответ: ∆Hº = -42,54 кДж/моль; ∆Sº = - 42,55 Дж/(моль * К); ∆Gº = -25,51 кДж/моль; ∆cPº = 12,00 Дж/(моль * К)
6. Для реакции 2SO2 + O2 → 2SO3
lgKa = 10679/T + 0,736lgT + 0,114*10-3T – 0,354*105/T2 – 12,419
Вывести уравнения ∆Hº; ∆Sº; ∆Gº; ∆cPº = f (T) и вычислить значения этих величин при 1000 К.
Ответ: ∆Hº = -194,68 кДж/моль; ∆Sº = - 184,05 Дж/(моль * К); ∆Gº = -10,50 кДж/моль; ∆cPº = 9,13 Дж/(моль * К)
7. Равновесное давление водяного пара по реакции Ca(OH)2 → CaO + H2O равно 100 мм рт. ст. при 450 ºС и 400 мм рт. ст. при 531 ºС. Найдите среднее значение энтальпии в данном интервале температур. Найдите температуру при которой равновесное давление паров воды составит 200 мм рт. ст.
Ответ: 82,713 кДж/моль; 761,4 К
8. Степень диссоциации PCl5 при 473 К и P = 1 атм равна 0,485, а при 523 К и P = 1 атм – 0,8. Рассчитайте средний тепловой эффект реакции
PCl5 → PCl3 + Cl2 в пределе температур 473 – 523 К. Также определите значение константы равновесия при температуре 500 К.
Ответ: 73,33 кДж/моль; K473 = 0,299; K500 = 0,818; K523 = 1,778 атм.
9. Пользуясь справочными данными о приведённой энергии Гиббса и энтальпии образования веществ при 0 К рассчитать Ка реакции
N2 + O2 → 2NO при 1000 К
| N2 | O2 | NO | |
| (GºT – Hº0)/T | 197,93 | 212,08 | |
| Hºf,0 | 90,15 |
∆Hºf,0 = 180,3 кДж/моль; ∆(GºT – Hº0)/T = -23,99 Дж/(моль К)
Ответ: Ка = 7 * 10-9
10. Определить КР и КС реакции 2H2O → 2H2 + O2, если известны объём системы V, температура Т, степень диссоциации α, исходное число молей n0.
Ответ: КР = n0 α3RT/2V(1- α)2; КР = n0 α3/2V(1- α)2.
11. Выразить в общем виде КР для реакции 2CO2 → 2CO + O2, если степень диссоциации α, общее давление Р, число молей исходного вещества 2.
Ответ: КР = α3Р/(1 - α)2(2 + α).
12. Рассчитать равновесный выход продукта в реакции димеризации оксида азота 2NO2 → N2O4, если известны КР и общее давление Р. Исходное количество NO2 1 моль.
Ответ: КР = х(1-х)/(1-2х)2Р