СОДЕРЖАНИЕ
1. ВВЕДЕНИЕ
1.1 Сущность процесса электролиза криолитоглиноземного расплава
1.2 Виды сырья для получения алюминия и требования к ним
2. СПЕЦИАЛЬНАЯ ЧАСТЬ
2.1 Свойства и состав промышленного электролита
2.2 Влияние факторов и примесей
3. КПВО
3.1 Корректировка электролита CaF2
4. ЭКОНОМИЧЕСКАЯ ЧАСТЬ
4.1 Основные направления улучшения использования основных фондов
и производственных мощностей
5. ТЕХНИКА БЕЗОПАСНОСТИ
5.1 Санитарно-гигиенические характеристики условий труда
5.2 Электробезопасность
5.3 Техника безопасности при обслуживание ванн
6. ГРАФИЧЕСКАЯ ЧАСТЬ
6.1 Таблица. Влияние МПР на корректировки, на свойства электролита
6.2 Схема. Требования к электролиту
7. СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Сущность процесса электролиза криолитоглиноземного расплава
Современное произв6дство алюминия основано на электролитическом разложении глинозема (Al20)) с выделением на катоде металлического алюминия, а на аноде - газообразных продуктов электролиза. Процесс электролиза криолитоглиноземных расплавов можно произвести в электролитической ячейки.
Все содержимое ячейки размещается в керамическом тигле. Со стороны дна установлена графитовая пластина, к которой подведен отрицательный полюс от источника постоянного тока (катод). В верхней части ячейки помещается угольный анод, к которому подведен положительный полюс источника тока. Анод погружается в расплавленный электролит, роль которого заключается, во-первых, в образовании токопроводящей среды между катодом и анодом, во-вторых, в растворении глинозема.
Последний фактор весьма важен, т.к. он позволяет растворить порошковый оксид алюминия в жидкой фазе, где становится возможным его электролитическое разложение. В электролите Al20) диссоциируют на положительные ионы алюминия (катионы) и отрицательные кислородсодержащие ионы (анионы). Ниже слоя электролита размещается расплавленный алюминий, фактически выполняющий роль катода.
Присоединим ячейку к положительному и отрицательному полюсам источника тока и в цепи появится прямой электрический ток, т.е. поток электрических зарядов. В металлических проводниках и графите ток переносится за счет электронов (проводники 1-ro рода), а в жидких электропроводящих средах (электролитах) - за счет ионов (проводники Н-го рода). Проводники 1-гo рода, подводящие ток к электролитам, называют электродами.
Электрический ток, проходящий через электролит, вызывает в электролите химические изменения. Этот процесс носит название электролиза. В нашей ячейке на катоде появляются избыточные электроны, которые захватываются катионами алюминия и приводят к его восстановлению по реакции
AI3+ + 3е-= Аl
На аноде происходит поглощение электронов от отрицательно заряженных анионов. В суммарном виде анодная реакция может быть записана в следующем виде:
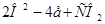
Образовавшийся на катоде алюминий, будучи по удельному весу тяжелее электролита, накапливается на дне ячейки и в последующем выполняет функции катода. Углекислый газ за счёт взаимодействия с углеродом анода частично восстанавливается по реакции С02 + С = 2СО и свободно удаляется от анода в систему газоотсоса.
Образовавшийся на катоде алюминий, будучи по удельному весу тяжелее электролита, накапливается на дне ячейки и в последующем выполняет функции катода. Углекислый газ за счёт взаимодействия с углеродом анода частично восстанавливается по реакции С02 + С = 2СО и свободно удаляется от анода в систему газоотсоса.
Добавим к этому, что в качестве электролита алюминиевой ячейки повсеместно используется криолит, имеющий формулу смеси двух солей 3NaF· AIF3 или в суммарном виде NазАlF6
Криолит в расплавленном состоянии хорошо растворяет и достаточно электропроводен для использования в электролизе. Электролит по удельному весу легче металла, поэтому он находится над поверхностью алюминия в виде расплавленного слоя.
В таком виде способ производства алюминия электролизом глинозема в расплаве криолита был изобретен одновременно двумя ерами П.Эру (Франция) и Ч.Холлом (США) в 1886г. и до на д настоящего времени в принципе сохраняется неизменным.
Агрегат для промышленного производства алюминия носит название алюминиевого электролизера или алюминиевой ванны. В инструкцию электролизера заложены те же основные принципы, что в элементарной ячейке. Содержимое электролизера - расплавленный электролит и алюминий находятся в ванне, ограниченный угольной подиной и бортовой футеровкой. Ниже подины размещена футеровка из огнеупорного и термоизоляционного материалов. Ток в подину проводится с помощью стальных стержней (блюмсов), соединенных с катодной ошиновкой. Через анодную ошиновку ток проводится к анодному устройству и непосредственно к угольным анодам. Анод находится в полупогруженном состоянии в электролите, расстояние между анодом и расплавленным алюминием носит название междуполюсного расстояния (МПР)