Часть 1
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Na 2) K 3) Si 4) Mg 5) C
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне четыре электрона.
2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
3. Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную –4.
4. Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
1) Ca(ClO2)2 2) HClO3 3) NH4Cl 4) HClO4 5) Cl2O7
5. Установите соответствие между формулой вещества и классом / группой, к которому(-ой) это вещество принадлежит:
А) NH4HCO3 1) соли средние 3) оксиды несолеобразующие
Б) KF 2) оксиды кислотные 4) соли кислые
В) NО
6. Из предложенного перечня веществ выберите два вещества, с каждым из которых железо реагирует без нагревания.
1) хлорид кальция (р–р) 2) сульфат меди(II) (р–р) 3) конц. азотная кислота
4) разбавленная соляная кислота 5) оксид алюминия
7. В одну из пробирок с осадком гидроксида алюминия добавили сильную кислоту X, а в другую – раствор вещества Y. В результате в каждой из пробирок наблюдали растворение осадка. Из предложенного перечня выберите вещества
X и Y, которые могут вступать в описанные реакции.
1) бромоводородная кислота 2) гидросульфид натрия
3) сероводородная кислота 4) гидроксид калия 5) гидрат аммиака
8. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать:
А) S 1) AgNO3, Na3PO4, Cl2
|
|
Б) SO3 2) BaO, H2O, KOH
В) Zn(OH)2 3) H2, Cl2, O2
Г) ZnBr2 (р–р) 4) HBr, LiOH, CH3COOH (р–р)
5) H3PO4 (р–р), BaCl2, CuO
9. Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ:
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫРЕАКЦИИ
А) Mg и H2SO4(конц.) 1) MgSO4 и H2O 4) SO2 и H2O
Б) MgО и H2SO4 2) MgO, SO2 и H2O 5) MgSO4, H2S и H2O
В) S и H2SO4(конц.) 3) H2S и H2O 6) SО3 и H2О
Г) H2S и O2(изб.)
10. Задана следующая схема превращений веществ: CO2 → X K2CO3 → Y KHCO3 Определите, какие из указанных веществ являются веществами X и Y.
1) KCl (р-р) 2) K2O 3) H2 4) HCl (избыток) 5) CO2 (р-р)
11. Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит:
А) метилбензол 1) альдегиды 3) аминокислоты
Б) анилин 2) амины 4) углеводороды
В) 3-метилбутаналь
12. Из предложенного перечня выберите два вещества, которые являются структурными изомерами бутена-1.
1) бутан 2) циклобутан 3) бутин-2 4) бутадиен-1,3 5) метилпропен
13. Из предложенного перечня выберите два вещества, при взаимодействии которых с раствором перманганата калия в присутствии серной кислоты будет наблюдаться изменение окраски раствора.
1) гексан 2) бензол 3) толуол 4) пропан 5) пропилен
14. Из перечня выберите два вещества, с которыми реагирует формальдегид.
1) Сu 2)N2 3) H2 4) Ag2O (NH3 р-р) 5) СН3ОСН3
15. Из перечня выберите два вещества, с которыми реагирует метиламин.
1) пропан 2) хлорметан 3) водород 4) гидроксид натрия 5) соляная кислота
16. Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромом:
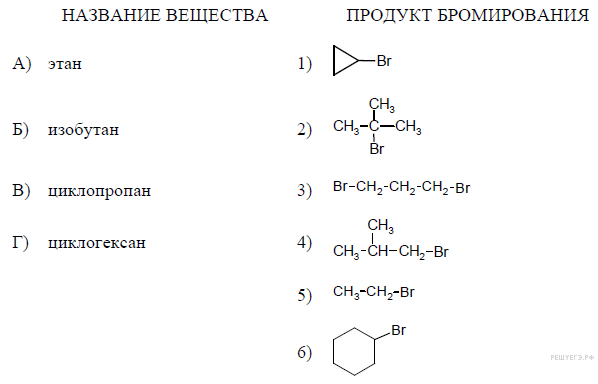
17. Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при их взаимодействии: РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
|
|
A) уксусная кислота и сульфид натрия 1) пропионат натрия
Б) муравьиная кислота и гидроксид натрия 2) этилат натрия
В) муравьиная кислота и гидроксид меди (II) (при нагр.) 3) формиат меди (II)
Г) этанол и натрий 4) формиат натрия
5) ацетат натрия
6) углекислый газ
18. Определите веществ Х и Y в схеме превращений:
CH3CH2Cl → X CH3CH2OH → Y CH3CHO
1) H2 2) CuO 3) Cu(OH)2 4) NaOH (H2O) 5) NaOH (спирт)
19. Из предложенного перечня типов реакций выберите два типа реакции, к которым можно отнести взаимодействие щелочных металлов с водой.
1) каталитическая 2) гомогенная 3) необратимая
4) окислительно-восстановительная 5) реакция нейтрализации
20. Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к уменьшению скорости реакции этилена с водородом.
1) понижение температуры 2) увеличение концентрации этилена
3) использование катализатора 4) уменьшение концентрации водорода
5) повышение давления в системе
21. Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции:
А) NH4HCO3 = NH3 + H2O + CO2 1) является окислителем
Б) 3СuO + 2NH3 = N2 + 3Cu + 3H2O 2) является восстановителем
В) 4NH3 + 5O2 = 4NО + 6H2O 3) и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
22. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах:
А) Na3PO4 1) H2, O2 4) H2, Cl2
|
|
Б) KCl 2) Сu, O2 5) Cu, NO2
В) CuBr2 3) Cu, Br2
Г) Cu(NO3)2
23. Установите соответствие между названием соли и отношением ее к гидролизу:
А) хлорид аммония 1) гидролизуется по катиону
Б) сульфат калия 2) гидролизуется по аниону
В) карбонат натрия 3) гидролизу не подвергается
Г) сульфид алюминия 4) гидролизуется по катиону и аниону
24. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
А) N2(г) + 3H2(г) ↔ 2NH3(г) 1) смещается в сторону прямой реакции
Б) 2Н2(г) + О2(г) ↔ 2Н2О(г) 2) смещается в сторону обратной реакции
В) H2(г) + Cl2(г) ↔ 2НCl(г) 3) практически не смещается
Г) SO2(г) + Cl2(г) ↔ SO2Cl2(г)
25. Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы:
А) HNO3 и NaNO3 1) Cu 4) KNO3
Б) KCl и NaОН 2) KOH 5) CuSO4
В) NaCl и BaCl2 3) HCl
Г) AlCl3 и MgCl2
26. Установите соответствие между веществом и областью его применения:
A) метан 1) получение капрона
Б) изопрен 2) в качестве топлива
В) этилен 3) получение каучука
4) получение пластмасс
Ответом к заданиям 27–29 является число.
27. Вычислите массу нитрата калия (в граммах), которую следует растворить в 150,0 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. (Запишите число с точностью до десятых.)
28. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж, выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
29. Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода. (Запишите число с точностью до десятых.)
Часть 2
Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
30. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
31. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
32. При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите уравнения четырёх описанных реакций.
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH3CH2CH2OH H2SO4 180° X1 HCl X2 NaOH,H2O X3 → X1 KMnO4,H2O,0° C X4
34. При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе. 35. Органическое вещество А содержит 11,97% азота, 9,40% водорода и 27,35% кислорода по массе и образуется при взаимодействии органического вещества Б с пропанолом-2. Известно, что вещество Б имеет природное происхождение и способно взаимодействовать как с кислотами, так и со щелочами. На основании данных условия задания: установите молекулярную и структурную формулы исходного органического вещества; напишите уравнение реакции получения вещества А из вещества Б и пропанола-2 (используйте структурные формулы органических веществ).