Адсорбция
1. Что такое поверхностно-активные вещества ПАВ
– Вещества, которые уменьшают поверхностное натяжение σ
2. Какие вещества называют поверхностно-инактивными ПИВ
– Вещества которые повышают поверхностное натяжение σ
3. Какое явление проявляется в хроматографии
– Адсорбция
4. Основная особенность молекул ПАВ
– Наличие гидрофильной полярной группы (–СООН, –ОН) и гидрофобного радикала (СН3–, С2Н5–)
5. Выберите ПАВ
– С17Н35СООН
– бутановая кислота
6. Выберите ПИВ
– KCl
– H3PO4
7. Что происходит при положительной адсорбции
– На поверхности жидкости концентрация веществ больше чем в растворе
8. Что происходит при отрицательной адсорбции
– Концентрация веществ на поверхности меньше, чем в растворе
9. Как уменьшить величину поверхностного натяжения σ
– Добавить ПАВ
10. От какого фактора зависит величина поверхностного натяжения δ
– От суммарной поверхности и природы вещества
11. Какое соединение обладает наибольшей поверхностной активностью
– C4H9COOH (с наибольшим УВ радикалом)
12. Какие ионы адсорбируются на твердой поверхности AgCl, если идет реакция AgNO3+HCl(избыток)
– Ионы Cl-
13. Какие ионы адсорбируются на AgI в реакции AgNO3+KI(избыток) => AgI
– Ионы I-
14. Какие ионы адсорбируются на BaSO4 BaCl2+H2SO4(избыток)
– Ионы Ba2+
15. Какой из ионов обладает наибольшей адсорбционной способностью
– AsO43- (чем больше заряд, тем больше адсорбирующая способность)
16. Какая связь между F, σ, S
– F=σS
17. Что такое адсорбтив
– Вещество, которое накапливается на поверхности другого вещества
18. Уравнение Гиббса для адсорбции
– Г=(C/RT)*(Δσ/ΔC) устанавливает связь между адсорбцией и поверхностной активностью
19. Что такое адсорбция
- изменение концентрации компонента на поверхности по сравнению с объемом
Коагуляция
1. Каким методом можно определить знак заряда гранулы
– Электрофорезом
2. Что такое коагуляция
– Процесс объединения частиц дисперсной фазы в крупные агрегаты
3. Какой ряд правильно отражает коагулирующую способность
– РРО43->PCO32->PCl-
– PAl3+>PCa2+>PK+
4. На чем основана коагуляция электролитами
– Ионы электролита снижают заряд гранулы
5. Что такое агрегативная устойчивость
– Способность коллоидного раствора сохранять степень дисперсности и не объединятся в крупные агрегаты
6. Что такое кинетическая устойчивость
– Способность дисперсной системы находиться во взвешенном состоянии и не седиментировать (оседать)
7. Что такое порог коагуляции
– Концентрация электролита, при которой происходит коагуляция
8. От каких факторов зависит заряд в мицелле
– От знака заряда потенциалопределяющих ионов (ПОИ)
9. Какие ионы будут ПОИ в мицелле золя BaSO4, если H2SO4 + BaCl2 => BaSO4 +...
– Ba2+ ионы
10. Какие ионы будут противоионами в мицелле BaSO4 если H2SO4 + BaCl2 => BaSO4 + HCl
– Противоионы Cl-
11. Потенциалопределяющие ионы для [ВаSO4↓] полученного при действии BaCl2 + H2SO4 изб.
- SO42-
12. Какой знак заряда на грануле в мицелле
– Знак заряда ПОИ
13. Правильный ряд порога коагуляции
– CK+>CCa2+>CAl3+
– CCl->CCO32->CPO43-
41. Что такое коацервация
- выделение белка из раствора при высаливании
Буферные системы
1. Какую характеристику можно рассчитать по уравнению Гендерсона-Хессельбаха
– рН буферного раствора
2. Определите какие компоненты образуют буферную систему
– СН3СООН + СН3СООNa
3. Компоненты фосфатного буфера
– NaH2PO4 + Na2HPO4
4. Выбрать буферную систему «Слабое основание и его соль с сильной кислотой»
– Аммиачный буфер
5. Какие компоненты создают буферную систему
– Слабая кислота и его соль с сильным основанием
6. Почему плазма крови обладает буферным действием?
– Для эффективной работы ферментов
7. рН крови в норме
– 7,35 – 7,45
8. буферная система, поддерживающая рН крови
– бикарбонатная
9. буферная система мочи
– фосфатная
10. характеристика буферной ёмкости
– число молей сильной кислоты или основания, которое нужно добавить к 1л буферного раствора, чтобы изменить его рН на единицу
11. При каком соотношении для буферных систем рН=рКа
– При соотношении Ск-ты/Ссоли=1
12. Механизм действия буферных систем
– Компоненты буферной системы связывают ионы Н+ и ОН- кислот и оснований в слабый электролит
13. Рассчитайте рН фосфатного буфера, если соотношение компонентов =1,
– рН = рК
14. Рассчитайте рН ацетатного буфера, если соотношение Сс/Ск= 2/1, рКа=4,8, Lg2=0,3
– рН = рК + lg2 = 5.1
15. При каком соотношении буферная емкость максимальна
– 1:1
16. Слабое основание и его соль
– Аммиачный буфер
Дисперсные системы
1. Что такое золи
– Коллоидные растворы, размер 10-9-10-7м
2. Что такое суспензия
– Грубодисперсная система типа т/ж
3. Что такое эмульсия
– Грубодисперсная система типа ж/ж
4. Что такое аэрозоль
– Дисперсная система типа ж/г
5. От какого фактора зависит интенсивность рассеянного золями света
– От длины волны падающего света
6. Что такое диализ
– Очистка золя от примесей электролита
7. Метод получения золей
– Диспергирование (дробление)
– Пептизация
8. Какие эмульгаторы используются для эмульсии типа «вода в масле»
– Соли жирных кислот
9. Роль эмульгатора в эмульсии
– Увеличивают устойчивость эмульсии
– Стабилизируют эмульсию
10. Что нужно для получения эмульсии «масло в воде »
– Гидрофильный эмульгатор
11. Свойство коллоидного раствора
– Не проходят через диализационные мембраны
– Рассеивают свет
12. Свойство гидрофобной коллоидной системы
– Термодинамически не устойчива
13. Что такое пептизация
– Переход геля в золь
14. Свойство гидрофобного золя
– способность к коагуляции
17. В каком направлении диффундурует вещество в растворе
- из большей концентрации в меньшую
18. Свойства гидрофобных золей
- гетерогенность
21. Способы получения золей
- диспергирование
22. Получение «масло в воде»
- взять меньше V масла и больше V воды
23. Конденсационные методы получения золей
- замена растворителя
Кинетика
1. Какое основное различие ферментов от небиологических катализаторов
– Высокая специфичность действия и селективность
2. Какая роль ферментов в организме
– Являются катализаторами биохимических реакций
3. Укажите выражение для скорости реакции 3H2 + N2 = 2NH3
– v=K[N2][H2]3
4. Как можно сдвинуть равновесие в системе 3H2 + N2 = 2NH3 – ΔН
– Уменьшить температуру, увеличить давление
5. В чем заключается механизм действия ферментов
– Ферменты понижают энергию активации процесса реакции
6. Что называют хим. Равновесием
– Состояние системы, когда концентрация исходных веществ и продуктов реакции постоянны
7. Какие процессы происходят в системе если
– Кр<1 – равновесие смещается в сторону исходных веществ
– Кр=1 – химическое равновесие
– Кр>1 – равновесие смещается в сторону продуктов реакции
8. В какую сторону смещается равновесие в системе СО32-+Н2О ó HCO3-+OH-
– Добавлении ОН- в сторону образование Н2О
– Добавлении Н+ в сторону образования НСО3-
9. Какой физический смысл имеет константа равновесия
– Показывает скорость реакции при концентрации реагирующих вещест, равной 1.
10. От какого фактора зависит величина константы равновесия
– От природы реагирующих веществ
- от природы растворенного вещества
11. Уравнение скорости реакции А+2В = С
– v=k[A][B]2
12. От какого фактора зависит константа скорости
– От температуры
13. Уравнение скорости реакции С+О2=СО2
– v=k[O2]
14. Отличие Гомогенного катализа от Гетерогенного
- гомогенный в одной фазе, гетерогенный в разных (катализатор и вещества)
Термодинамика
1. Что такое энтальпия системы?
– теплосодержание системы.
2. Самопроизвольно протекают процессы…
– которые идут с увеличением энтропии.
3. Энтропия тем больше чем…
– больше неупорядоченность системы.
4. Открытая система по отношению к окружающей среде…
– обменивается с ней массой и энергией.
5. Что такое внутренняя энергия?
– сумма энергий всех микрочастиц системы, без кинетической и потенциальной.
6. Что такое энтальпия системы?
– сумма внутренней энергии и работы расширения  , где
, где 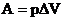 .
.
7. Изолированная система…
– не обменивается с окружающей средой ни массой, ни энергией
8. Уравнение для расчета свободной энергии Гиббса:
– 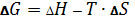 .
.
9. Чем измеряется тепловой эффект реакции в изобарных условиях?
– изменением энтальпии.
10. Как меняется энтропия системы, если протекает самопроизвольный спонтанный процесс?
– увеличивается.
Комплексные соединения
1. Чем определяется заряд комплексного иона
– Зарядом внешней сферы, взятым с обратным знаком
2. Что такое координационное число
– Число связей, связывающих центральный атом (комплексообразователь) с лигандами
3. Роль атомов и катионов металла в комплексных соединениях
– Центральный атом, комплексообразователь
4. Какие частицы играют роль лигандов
– Анионы электролитов и нейтральные молекулы
5. Тип связи в комплексные соединения
– Ковалентная, донорно-акцепторная
6. Степень окисления комплексообразователя в К[А1(ОН)4]
– +3
7. Какие частицы играют роль комплексообразователя
– Атомы и катионы металлов
8. Найти комплексообразователь в К3[А1(ОН)6]
– А13+
9. Определить координационное число в K2[Zn(OH)4]
– 4
10. Указать частицы лиганды в комплексе K2[Be(S04)2]
– их дентантность S042-, лиганд бидентантный
11. Чему равно координационное число в [Cu(NH3)4(OH)2]
– 6
12. Комплексная соль K4[Fe(CN)6]. Определить внешнюю и внутреннюю сферу
– К+ - внешняя сфера [Fe(CN)6]4- - внутренняя сфера
13. Что характеризует дентатность лиганда
– Число связей центрального атома с лигандом
14. K3[Fe(SCN)6]
– C.O. железа - +3
15. K2[Zn(SO4)2]
– координационнное число – 4
Осмос
1. Какие условия нужны для возникновения осмоса
– Контакт двух растворов с разной концентрацией через полупроницаемую мембрану.
2. Закон Вант-Гоффа для осмотического давления
– P=CRT – для неэлектролитов (сахароза, глюкоза)
– R=iCRT – для электролитов (соли, кислоты, щелочи)
3. Уравнение для расчета осмотического давления
– KCl – P=2CRT
– CuCl2 – P=3CRT
– AlCl3 – P=4CRT
– Al2(SO4)3 – P=5CRT
4. Укажите раствор с наибольшим осмотическим давлением
– AlCl3 (распадается на наибольшее число ионов)
5. Формула для расчета изотонического коэффициента
– Зависит от степени диссоциации электролита
– і=1+α(δ-1)
6. Чему равен pH крови в норме
– pH=7.35-7.45
7. Что такое «депрессия крови»
– Понижение температуры замерзания плазмы крови по сравнению с водой
8. Что такое гемолиз
– Разрыв оболочек эритроцитов, помещенных в гипотонический раствор
9. Что такое плазмолиз
– Сжатие эритроцитов, помещенных в гипертонический раствор
10. Формула для расчета осмотического давления
– P=CRT
11. Формула для повышения температуры кипения сахарозы
– Δtкип=Em
12. Как изменится температура кипения воды, если в ней растворить некоторое количество сахара
– Повысится
13. От каких факторов зависит осмотическое давление раствора
– От молярной концентрации растворенного вещества
14. Какой раствор NaCl изотоничен крови
– 0,9% NaCl
15. Как изменится температура замерзания, если добавить растворенное вещество
– Понизится
16. Какие растворы называют гипотонические
– Растворы, осмотическое давление которых меньше чем у крови
17. Изотонические растворы по отношению друг к другу
– Имеют одинаковые осмотические давления
18. Какие растворы называют гипертоническими
– Растворы, осмотическое давление которых больше чем у крови
19. Укажите причину отеков
– Уменьшается осмотическое давление крови
20. Что такое онкотическое давление крови
– Давление крови, обусловлено белками
21. Чему равно осмотическое давление крови
– P=7,7 – 8 атм
22. Укажите раствор для лечения гнойных ран
– Гипертонический, 2% NaCl
23. Укажите физиологические растворы
– 0,9%- NaCl
– 5% - глюкозы
24. Каким методом можно определить осмотическую концентрацию раствора
– Криометрия
25. От чего не зависят коллигативные свойства
- от природы вещества
Растворы ВМС (биополимеры)
1. Выберите биополимеры
– Полисахариды, полипептиды, нуклеиновые кислоты.
2. Что такое коацервация
– Слияние водных оболочек нескольких частичек.
3. Какое вещество будет осаждать белок в ЦЭТ
– Этанол
4. Что такое коллоидная защита
– Стабилизация золей по отношению к электролитам, путем добавления ВМС
5. Фактор высокой устойчивости р-ров белка
– Заряд белка и сольватная (гидратная) оболочка.
6. Что такое набухание
– Поглощение белком растворителя и увеличение объема и массы.
7. Что происходит на первой стадии набухания
– Поглощение небольшого кол-ва растворителя с выделением теплоты.
8. От каких факторов зависит подвижность молекулы белка
– От величины заряда белковой молекулы.
9. Что такое ИЭТ белка
– Значение рН при котором заряд белка равен 0.
10. Как заряжен белок в кислой среде
– Положительно СООН-R-NH3.
11. Как заряжен белок в щелочной среде
– Отрицательно COO-R-NH2
12. Что такое денатурация
– Потеря свойств белковой молекулы, все структуры разрушаются, кроме первичной структуры.
13. По какой реакции получают растворы ВМС
– Полимеризация
14. Вещества для проведения высаливания белка по Кройту
- спирт + электролит
Водородный показатель
1. Что такое водородный показатель
– Отрицательный десятичный логарифм концентрации ионов водорода
2. Уравнение связывающее рН и рОН
– рН+рОН=14
3. Что такое ионное произведение воды
– Произведение концентраций [H+], [OH-]
– [H+][OH-]=10-14
4. рН мочи = 6. Какая это среда? Норма или патология
– слабокислая, норма
5. что наблюдается при ацидозе
– смещение рН в кислую область
– рН уменьшается
6. что наблюдается при алкалозе
– смещение рН в щелочную область
– рН увеличивается
7. рН = 9.5-10. Какая это среда
– щелочная
8. [H+]=10-2 pH -? pH=-lg[H+]
– pH=2
9. pH=1 [H+]-?
– [H+]=10-1
10. [H+]=10-7 pH -? какая это среда
– pH=7 среда нейтральная
11. [OH-]=10-6 pH -? pOH=6 pH=14 – pOH
– pH=8
12. От чего зависит ионное произведение воды?
– От температуры
13. [OH-]=10-5 pH -?
- 9
Перманганатометрия
1.В какой среде проводится определение восстановителей в методе перманганатометрии
– кислой
2.Как опеределить точку эквивалентности в методе пермангонатометрии
– по появлению розовой окраски
3. Почему нельзя HNO3?
–обладает окислительными свойствами
4. НCl?
–обладает восстановительными свойствами
5.Зачем нагревают?
–Увеличение скорости реакции
6. Какой индикатор
–без индикаторный метод
7. Для каких в-в именяют прметод перманганометрии
–для восстановителей
________________________________________________________________
1. Электронная конфигурация кислорода
- 1s22s22p4