ЗАДАНИЕ № 1
| № варианта | Содержание задания |
| Сколько граммов NaOH необходимо взять для приготовления 200см3раствора с концентрацией 0,05 моль/дм3 | |
| Сколько граммов КОН необходимо взять для приготовления 300см3 раствора с концентрацией 0,1 моль/дм3 | |
| Сколько граммов NaOH необходимо взять для приготовления 1,5 дм3 раствора с концентрацией 1 моль/дм3 | |
| Сколько граммов КOH необходимо взять для приготовления 500см3раствора с концентрацией 2 моль/дм3 | |
| Сколько см3 раствора КОН плотностью 1,120г/см3 потребуется для приготовления 200 см3 раствора с концентрацией 0,1 моль/дм3 | |
| Сколько см3 раствора NaOH плотностью 1,180г/см3 потребуется для приготовления 200 см3 раствора с концентрацией 0,2 моль/дм3 | |
| Сколько см3 раствора КОН плотностью 1,295г/см3 потребуется для приготовления 300 см3 раствора с концентрацией 0,05 моль/дм3 | |
| Сколько см3 раствора NaOH плотностью 1,300 г/см3 потребуется для приготовления 100 см3 раствора с концентрацией 0,5 моль/дм3 | |
| Сколько см3 раствора КОН плотностью 1,180г/см3 потребуется для приготовления 100 см3 раствора с концентрацией 0,2 моль/дм3 | |
| Сколько см3 раствора NaOH плотностью 1,160г/см3 потребуется для приготовления 100 см3 раствора с концентрацией 0,1 моль/дм3 |
ЗАДАНИЕ № 2
| № варианта | Содержание задания |
| Какую навеску янтарной кислоты следует взять для установки титра примерно 0,4 н раствора NаОН методом отдельных навесок, чтобы на титрование расходовалось не более 25 см3 устанавливаемого раствора? | |
| Сколько граммов кристаллической щавелевой кислоты следует взять для установки титра 0,5н раствора КОН методом отдельных навесок, чтобы на титрование расходовалось около 25 см3 устанавливаемого раствора? | |
| Для установки титра раствора НСl навеска безводной соды (х.ч.) 5,2060 граммов растворена в мерной колбе на 500 см3. На титрование 25 см3 раствора расходуется 26,18 см3 устанавливаемого раствора. Определить: нормальную концентрацию эквивалента НСl, К НСl. | |
| Для установки титра раствора Н2 SO4 взято 20 см3 раствора NаОН (Т= 0,0019г/ см3) и оттитрована устанавливаемым раствором, которого на это израсходовано 22,4 см3. Вычислить Т Н2 SO4 | |
| Для установки титра раствора НСl взято 20 см3 раствора NaOH (Т = 0,0398 г/см3) раствор разбавлен водой в колбе на 20 см3.На титрование 20 см3 полученного раствора расходуется 18,95 см3 раствора HCl. Определить: КHCl и ТHCl | |
| Для установки титра раствора KOH 5,9840 г H2C2O4*2H2O растворена в мерной колбе на 1000см3. На титрование 25 см3 полученного раствора расходуется 26,35 см3 раствора КОН. Определить: СнKOH TKOH/HCl. | |
| На титрование раствора, содержащего 0,2584 г безводной соды, расходуется 21,35 см3 раствора серной кислоты. Определить: ТH2SO4, ТH2SO4/NaOH. | |
| Навеска H2C2O4*2H2O 0,0792 г растворена в произвольном объеме воды и оттитрована раствором NaOH, которого израсходовано 24,12 см3. Определить: КNaOH. | |
| На титрование раствора HCl расходуется 18,68 см3 0,1 н раствора NaOH. Определить: КHCl | |
| Для установки титра Н2SO4 взято 20 см3 0,1 н раствора буры. На титрование израсходовано 19,20 см3 устанавливаемого раствора. Определить: CнH2So4/ ТH2SO4. |
ЗАДАНИЕ № 3
| № варианта | Содержание задания |
| Вычислить массу навески соды на титрования которой по метиловому оранжевому расходовалось бы 15 см3 0,20 М раствора соляной кислоты | |
| Чему равна масса серной кислоты содержащейся в растворе, если на её титрование расходуется 23,50 см3 раствора NaOH с титром 0,005764 г/см3 | |
| Рассчитать массу навески не гашеной извести, содержащей около 90% СаО на титрование раствора которой нужно затратить 20 см3 раствора HCl с титром 0,0103 г/см3 | |
| Вычислить массу CaО, если на титрования его раствора пошло 18,43 см3 0,2135 н раствора НСl. | |
| Сколько см3 серной кислоты плотностью 1,07 г/см3 с массой долей H2SO4 10 % нужно взять для анализа, чтобы на её титрование пошло 20 см3 2,0М раствора NaOH? | |
| Рассчитать массу бария в растворе гидроксила бария на титрование которого затрачено 9,57 см3 0,1136 н НСl. | |
| Сколько см3 соляной кислоты с титром по оксиду кальция 0,0080 г/см3 потребуется для реакции с 0,300 г CaO. | |
| Рассчитать массовую долю основного компонента Na2B4O7*10H2O в загрязненной буре, если при титрование 0,8530 г её идет 20,20 см3 0,2100 н раствора HCl | |
| Какую навеску каустической соды следует взять для анализа на содержание NaOH, чтобы на титрования полученного из неё раствора расходовалось около 30 см3 0,5 М раствора HCl | |
| При титрования 20,00 см3 раствора Na2Co3 пошло 19,16 см3 0,9960 н раствора соляной кислоты. Вычислить массовую долю соды в растворе, если плотность раствора составило 1,050 г/см3 |
ЗАДАНИЕ № 4
Уравнять реакции методом электронно-ионного баланса
| № варианта | Содержание задания |
| HI+H2SO4®I2+H2O+H2S | |
| CrCl3+Br2+KOH®K2CrO4+KBr+KCl+H2O | |
| KI+KIO3+H2SO4®K2SO4+I2+H2O | |
| MnSO4+KСlO4+KOH®K2MnO4+KCl+K2SO4+H2O | |
| K2Cr2O7+Na2SO3+H2SO4®Na2SO4+K2SO4+Cr2(SO4)3+H2O | |
| Na2SeO3+Cl2+NaOH®Na2SeO4+NaCl+H2O | |
| KMnO4+KI+H2SO4®K2SO4+MnSO4+I2+H2O | |
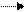 Сl2 + NaOH NaCl + NaClO + H2 O Сl2 + NaOH NaCl + NaClO + H2 O
| |
| NaBr+NaBrO3+H2SO4®Br2+Na2SO4+H2O | |
| Cr2(SO4)3+Br2+NaOH®Na2CrO4+NaBr+Na2SO4+H2O |
ЗАДАНИЕ № 5
| № варианта | Содержание задания |
| Сколько граммов КМпО4 потребуется для приготовления 750 см3 примерно 0,05н раствора? | |
| Чему равна молярная масса эквивалента FeSO4 7H2O в реакциях окисления КМпО4 в кислой среде? Подтвердить схемами полуреакций. | |
| Сколько граммов КМпО4 потребуется для приготовления 1,5 дм3 примерно 0,2н раствора? | |
| Чему равна молярная масса эквивалента Na2C2O4 в реакциях окисления КМпО4 в кислой среде? Подтвердить схемами полуреакций. | |
| Сколько граммов КМпО4 потребуется для приготовления 1250 см3 раствора, титр которого равен 0,001617г/см3 | |
| Чему равна молярная масса эквивалента NaNO2 в реакциях окисления КМпО4 в кислой среде? Подтвердить схемами полуреакций. | |
| Сколько граммов КМпО4 потребуется для приготовления 1 дм3 раствора, у которого К= 1,125 к 0,05н раствору? | |
| Чему равна молярная масса эквивалента Na2SO3 в реакциях окисления КМпО4 в кислой среде? Подтвердить схемами полуреакций. | |
| Сколько граммов КМпО4 потребуется для приготовления 5 дм3 раствора, у которого Т КМпО4/ Fe =0,005585 г/см3 | |
| Сколько граммов КМпО4 потребуется для приготовления 800 см3 раствора, у которого Т КМпО4/H2C2O4 = 0,00335 г/см3? |
ЗАДАНИЕ №6
| № варианта | Содержание задания |
| Рассчитать молярную концентрацию и титр по СаО для рабочего раствора ЭДТА, если при титровании навески 0,1045г СаСО3 затрачено 21,06 см3 его. | |
| Сколько граммов ЭДТА*2Н2О потребуется для приготовления 500см3 0,02 н раствора? | |
| Сколько граммов металлического цинка следует растворить в кислоте, если для определения точной концентрации 0,н раствора комплексона III методом пипетирования используют пипетку и мерную колбу номинальной вместимостью 20 и 200 см3 соответственно и бюретку на 25см3? | |
| Чему равна молярная концентрация цинка в растворе, если при титровании 20,15 см3 этого раствора в присутствии индикатора хромогена черного Т пошло 9,35см3 0,05н раствора комплексона III. | |
| Рассчитать навеску NiCl2 в растворе, на титрование которого затрачено 20,45 см3 0,05115М раствора комплексона III. | |
| Рассчитать массовую концентрацию цинка в руде, если на титрование раствора, приготовленного из ее навески 0,9003г, затрачено 19,51см30,1015 н раствора ЭДТА. | |
| Рассчитать навеску для приготовления 2,5 дм3 примерно 0,1н рабочего раствора Трилона Б. | |
| Сколько граммов Трилона Б нужно взять для приготовления раствора, которым определяют магний в минерале, содержащим его около 15%. Учесть, что 1г образца растворена мерной колбе на 500см3 | |
| Определить % содержание карбоната натрия, если навеска образца 0,2458г растворена и к полученному раствору добавлено 20 см3 0,045н раствора MgSO4. Избыток последнего оттитрован 15 см3 ЭДТА. Учесть, что 1 см3 MgSO4 эквивалентен 1,25 см3 ЭДТА. | |
| При нахождении суммарного количества ионов кальция и магния на титрование 20см3 воды пошло20см3 0,05н раствор комплексона III.. |
ПРИЛОЖЕНИЕ В
Вопросы к зачету
1 Место и роль аналитической химии в системе получения знаний.
2 Методы и способы анализа, и их особенности.
3 Методы математической обработки результатов анализа.
4 Аналитические реакции, способы их выполнения.
5 Методы качественного анализа.
6 Общая характеристика катионов и анионов.
7 Теоретические основы гравиметрического анализа.
8 Сущность титриметрического анализа.
9 Теоретические основы титриметрии, расчетные формулы.
10 Способы приготовления рабочих растворов.
11 Установление приготовленных растворов точной концентрации.
ПРИЛОЖЕНИЕ Г
Вопросы к экзамену
1 Сущность и теоретические основы метода кислотно-основного титрования.
2 Рабочие растворы метода кислотно-основного титрования.
3 Правила выбора индикатора.
4 Сущность и теоретические основы методов окисления-восстановления:
-перманганатометрия, -иодометрия.
5 Способы титрования в методах окисления-восстановления.
6 Сущность и теоретические основы метода крмплексонометрических определений.
7 Условия комплексонометрических определений.
8 Классификация физико-химических методов анализа.
9 Теоретические основы фотометрических определений.
10Сущность хроматографических методов анализа.
11Сущность электрохимических методов анализа.
Практические расчеты
1 Расчеты результатов анализа титриметрических определений.
2 Расчеты исходных веществ для приготовления растворов точных концентраций.
3 Построение градуировачных графиков зависимости абсорбционности от концентрации растворов.
4 Определение концентрации раствора по градуированному графику.
5 Расчет хроматограмм.
6 Оценка достоверности аналитических данных.