Скорость химической реакции. Закон действия масс
| 15. Скорость химической реакции
| На экране
Текст «Скорость химических реакций»
| | Реакция между уксусом и содой протекает моментально у нас на глазах, обычная железная скрепка растворяется в соляной кислоте примерно за 20 минут, процесс образования ржавчины на железном изделии протекает в течение нескольких лет. Эти примеры наталкивают на мысль, что химические реакции протекают с разной скоростью.
| Текст «Химические реакции протекают с разной скоростью»
| | Рассмотрим условную реакцию: А + В = С + D. Химические количества исходных веществ А и В с течением времени уменьшаются, а химические количества продуктов реакции С и D, наоборот, увеличиваются. Чем быстрее происходит процесс изменения концентраций веществ, тем больше скорость химической реакции.
| Текст «Условная реакция: А + В = С + D
Химические количества исходных веществ п (А) и п (В) с течением времени уменьшаются, а химические количества продуктов реакции п (С) и п (D), наоборот, увеличиваются. Чем быстрее происходит процесс изменения концентраций веществ, тем больше скорость химической реакции»
| | Для того чтобы определить скорость химической реакции нужно знать изменение химического количества одного из веществ, которое произошло за определенный промежуток времени, и объем сосуда, в котором протекает данная реакция. Если записать соотношение этих величин в виде дроби: дельта эн поделить на объем, умноженный надельта тэ, то получим математическое выражение скорости химической реакции в указанном промежутке времени. Известно, что отношение химического количества вещества к объему смеси выражает молярную концентрацию этого вещества. Тогда, если заменить дельта эн, деленное на объем молярной концентрацией, получается выражение: скорость химической реакции равна плюс минус отношению дельта цэк дельта тэ. Из чего следует определение: скорость химической реакции – это величина, которая равна отношению изменения молярной концентрации вещества к интервалу времени, в течение которого произошло данное изменение.
В связи с тем, что концентрация исходных веществ с течением времени уменьшается (а это значит, что изменение молярной концентрации будет иметь отрицательное значение) в формуле нахождения скорости реакции ставится плюс-минус ввиду того, что скорость химической реакции величина исключительно положительная.
Измеряется скорость химической реакции чаще всего в моль/л*с.
| Текст «Для того чтобы определить скорость химической реакции нужно знать изменение химического количества ∆п одного из веществ, которое произошло за определенный промежуток времени ∆t, и объем сосуда V, в котором протекает данная реакция. Если записать соотношение этих величин в виде дроби:
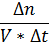 то получим математическое выражение скорости химической реакции в указанном промежутке времени. Известно, что
то получим математическое выражение скорости химической реакции в указанном промежутке времени. Известно, что
 Тогда, если заменить
Тогда, если заменить  молярной концентрацией, получается выражение:
v = ± молярной концентрацией, получается выражение:
v = ±  Из чего следует определение:
Cкорость химической реакции – это величина, которая равна отношению изменения молярной концентрации вещества к интервалу времени, в течение которого произошло данное изменение.
Измеряется скорость химической реакции чаще всего в моль/л*с»
Из чего следует определение:
Cкорость химической реакции – это величина, которая равна отношению изменения молярной концентрации вещества к интервалу времени, в течение которого произошло данное изменение.
Измеряется скорость химической реакции чаще всего в моль/л*с»
| | Это определение скорости химической реакции и формула справедливы только для гомогенных реакций. Гомогенные реакции – это реакции, протекающие в однородной среде, т.е. там, где нет поверхности раздела реагирующих веществ.
Соответственно, гетерогенные реакции – это реакции, протекающие между веществами в неоднородной среде, т.е. там, где есть поверхность раздела реагирующих веществ.
| Текст «Гомогенные реакции – это реакции, протекающие в однородной среде, т.е. там, где нет поверхности раздела реагирующих веществ.
Гетерогенные реакции – это реакции, протекающие между веществами в неоднородной среде, т.е. там, где есть поверхность раздела реагирующих веществ»
| | С ходом реакции ее скорость постепенно уменьшается и через определенный промежуток времени она заканчивается.
|  График «Изменение скорости химической реакции со временем» График «Изменение скорости химической реакции со временем»
| | Раздел химии, который посвящен изучению скорости химических реакций, называется химической кинетикой. Знание законов химической кинетики позволяет управлять химическими реакциями, что имеет большое практическое и научное значение.
| Текст «Химическая кинетика - раздел химии, который изучает скорость химических реакций»
| | На скорость химических реакций оказывают влияние определенные факторы: природа реагирующих веществ, их концентрация, температура, использование катализаторов, площадь поверхности соприкосновения реагентов. Рассмотрим каждый из них.
| Текст «На скорость химических реакций оказывают влияние определенные факторы: природа реагирующих веществ, их концентрация, температура, использование катализаторов, площадь поверхности соприкосновения реагентов»
| | 1. Каждое вещество обладает своими химическими свойствами и реакционной способностью, что напрямую зависит от его природы. Например, при взаимодействии с равными объемами соляной кислоты одинаковой массой кусков цинка, железа и меди мы увидим, что с цинком реакция протекает очень быстро и очень бурно, с железом реакция протекает более спокойно и медленнее, чем в случае с цинком, а с медью реакция и вовсе не идет.
| Текст «1. Природа реагирующих веществ »
 Рисунок «Взаимодействие соляной кислоты с цинком, железом и медью» Рисунок «Взаимодействие соляной кислоты с цинком, железом и медью»
| | 2. Скорость химических реакций сильно зависит от температуры. С увеличением температуры скорость химических реакций увеличивается. Например, при комнатной температуре свинец взаимодействует с серной кислотой очень медленно, но, если раствор кислоты подогреть, то будет наблюдаться явное усиление выделения газа, то есть увеличение скорости протекания реакции.
| Текст «2. Температура: с увеличением температуры скорость химических реакций увеличивается»
| | Количественная зависимость скорости реакций от температуры была установлена голландским ученым Вант-Гоффом в 1884 году.
|  Текст «Якоб Хендрик Вант-Гофф (1852 – 1911гг) -голландский ученый, один из основателей стереохимии и химической кинетики первый лауреат Нобелевской премии по химии» Текст «Якоб Хендрик Вант-Гофф (1852 – 1911гг) -голландский ученый, один из основателей стереохимии и химической кинетики первый лауреат Нобелевской премии по химии»
| | Им было сформулировано правило, названное в его честь, согласно которому при изменении температуры (повышении либо понижении) на каждые 10оС скорость реакции соответственно изменяется (увеличивается или уменьшается) в 2-4 раза. Математическое выражение этого правила описывается формулой: отношение скорости реакции при более высокой температуре тэ два к скорости реакции при более низкой температуре тэ один равно температурному коэффициенту скорости реакции гамма в степени разность температур, деленная на 10. Гамма – температурный коэффициент, который показывает во сколько раз увеличится скорость реакции с повышением температуры на 10оС. Уравнение Вант-Гоффа используют только для ориентировочной оценки влияния температуры на скорость реакции, так как оно показывает лишь приблизительные значения.
| Текст «Правило Вант-Гоффа: при изменении температуры (повышении либо понижении) на каждые 10оС скорость реакции соответственно изменяется (увеличивается или уменьшается) в 2-4 раза:
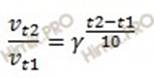 vt2 – скорость реакции при более высокой температуре t2,
vt1 - скорость реакции при более низкой температуре t1?
γ - температурный коэффициент, который показывает во сколько раз увеличится скорость реакции с повышением температуры на 10оС»
vt2 – скорость реакции при более высокой температуре t2,
vt1 - скорость реакции при более низкой температуре t1?
γ - температурный коэффициент, который показывает во сколько раз увеличится скорость реакции с повышением температуры на 10оС»
| | 3. Чем выше молярные концентрации реагирующих веществ в реакционной смеси, тем больше частиц содержится в ней, и тем чаще эти частицы будут сталкиваться друг с другом, что в свою очередь приводит к увеличению скорости реакции.
| Текст «3. Чем выше концентрация исходных веществ, тем больше скорость химической реакции.
| | Зависимость скорости химической реакции от концентрации реагирующих веществ описана основным законом химической кинетики (закон действующих масс), который был сформулирован норвежскими учеными К. Гульдбергом и П. Вааге в 1867 году.
| Рисунок «Норвежские ученые К. Гульдберг и П. Вааге»

| | Закон звучит следующим образом: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам.
Для простой одностадийной реакции типа: aA + bB → сС + dD математическое выражение закона действующих масс выглядит так: скорость химической реакции равна константа скорости химической реакции, равная скорости химической реакции при концентрации реагирующих веществ 1моль/л, умножить на молярную концентрацию вещества А в степени а, умножить на молярную концентрацию вещества В в степени b.
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах, и не распространяется на вещества в твердом состоянии, что связано с тем, что концентрация твердых веществ считается постоянной, так как взаимодействие возможно только на поверхности.
| Текст «Закон действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам.
Для уравнения:
aA + bB → сС + dD
v = k · С Aa · С Bb
где v - скорость реакции;
k - константа скорости химической реакции равная скорости химической реакции при концентрации реагирующих веществ 1моль/л;
C A и C B - концентрации реагентов A и B;
a и b - стехиометрические коэффициенты в уравнении реакции»
| | 4. Увеличить скорость химической реакции можно с помощью катализатора. Например, реакция разложения перекиси водорода при нагревании протекает очень медленно, но если в перекись добавить оксид марганца четвертой валентности, то будем наблюдать бурное выделение пузырьков кислорода. Катализатор – вещество, которое увеличивает скорость химической реакции, но само при этом не расходуется и в конечные продукты не входит. Процесс изменения скорости химической реакции добавлением катализатора называется катализом, а сами реакции – каталитическими. Биологические катализаторы белковой природы называются ферментами. Ферменты ускоряют процессы, идущие в живых организмах. Например, фермент, который помогает усвоению молока в организме – лактаза; фермент птиалин, присутствующий в слюне, помогает расщеплению полисахаридов до моносахаридов и т.д. Особенностью ферментов является то, что они действуют только в определенном интервале температур и определенной среде, что связано с их белковым происхождением. Кроме катализаторов существуют ингибиторы, которые служат для уменьшения скорости реакции. Их значение не менее важно. Например, с помощью ингибиторов замедляют процесс коррозии металлов, ингибиторами выступают лекарственные средства, замедляющие процесс развития болезней, опухолей.
| Текст «4. Катализатор – вещество, которое увеличивает скорость химической реакции, но само при этом не расходуется и в конечные продукты не входит.
Катализ - процесс изменения скорости химической реакции добавлением катализатора.
Каталитические реакции – реакции с участием катализаторов.
Ферменты - биологические катализаторы белковой природы.
Ингибиторы – вещества, которые служат для уменьшения скорости реакции»
| | 5. На скорость протекания гетерогенных реакций большое влияние оказывает величина площади соприкосновения реагирующих веществ. Чем больше площадь поверхности соприкосновения исходных веществ, тем больше частиц веществ сталкиваются друг с другом, тем выше скорость их взаимодействия, т.е. скорость реакции. Разберем на примере, если взять две пробирки с равными объемами соляной кислоты, и в одну бросить кусочек мела, а во вторую измельченный в порошок мел, то увидим, что в случае порошка реакция идет намного активнее, т.е. скорость реакции в данном случае выше. Зная это, для проведения гетерогенных реакций с участием твердых веществ их чаще всего предварительно измельчают для увеличения скорости реакции.
| Текст «5. Чем больше площадь поверхности соприкосновения исходных веществ, тем больше частиц веществ сталкиваются друг с другом, тем выше скорость их взаимодействия, т.е. скорость реакции.
|
| 3. Белки
| | Белки - это высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, соединенных пептидной связью.
Полимерные цепи белков состоят из десятков тысяч и более остатков аминокислот.
Ученые установили, что белки образуют 20 различных альфа- аминокислот.
Белок- полимер, состоящий из остатков α(альфа)-аминокислот, связанных между собой пептидными связями.
| | Биологическая роль белков в клетке и во всех жизненных процессах очень велика. Белки выполняют различные функции.
1.Каталитическая или ферментативная функция.
Ферменты- биокатализаторы, имеют белковую природу, увеличивают скорость химической реакции, а сами при этом не расходуются. Например, каталаза за 1 секунду разлагает до 100 000 молекул пероксида водорода при температуре ноль градусов.
2. Строительная или структурная- белки участвуют в построении клеточных мембран органоидов клетки. К структурным белкам относятся: кератин (ногти, волосы, рога, копыта), белок фибриноген, эластин (связки), коллаген (сухожилия, хрящи).
3.Двигательная – сократительные белки в мышцах- миозин, актин.
4.Защитная – к белкам относятся интерфероны, иммуноглобулины - это антитела;
в свертывании крови участвует тромбин- вещество белковой природы.
5.Сигнальная- белки- рецепторы воспринимают и передают сигналы, поступившие из окружающей среды или от соседних клеток, например, родопсин –фоторецептор сетчатки глаза.
6.Транспортная функция -транспорт кислорода и углекислого газа осуществляет гемоглобин.
7. Энергетическая- при расщеплении белка выделяется 17,6 кДж энергии.
8.Регуляторная- это работа гормонов, например, инсулин, вырабатываемый поджелудочной железой имеет белковую природу.
9.Запасающая- резервным источником энергии можно считать белки альбумин- белок куриного яйца, казеин- белок молока.
Роль белков в клетке объясняется многообразием их функций, поэтому они являются основой жизни.
В состав белка входят такие элементы, как углерод, водород, кислород, азот, фосфор, сера. Основополагающий вклад в разработку теории строения белков внесли работы Эмиль Герман Фишера, который в 1901 г. предположил и затем экспери-ментально обосновал положение о том, что белковые молекулы постро-ены из аминокислот, остатки которых соединены пептидными связями. Образующиеся таким путем полимеры обычно называют полипептидами, а учение о построении белковых молекул из аминокислот, соединенных пептидными связями, - полипептидной теорией строения белков.
| | Первичная структура белка – линейная. Это определенная последовательность соединения остатков аминокислот в полипептидной цепи.
Вторичная структура белка- представляет собой закрученную полипептидную линейную цепь в спираль. В результате скручивания, изгибания и сворачивания образуется спиралевидная структура белка, которая поддерживается внутримолекулярными водородными связями.
Третичная структура белка образуется при закручивании в пространстве вторичной структуры, при этом образуется клубок. Это клубочковидная структура. В формировании третичной структуры, кроме водородных связей принимают участие дисульфидные и ионные связи.
Четвертичная структура - еще более усложненная в пространстве третичная, когда отдельные субъединицы белка образуют сложные ансамбли, которые поддерживаются как водородными связями, так и электростатическим взаимодействием.
В основе всех четырех структур белка лежит первичная структура. Поэтому исключительная роль в организации более высоких структур белка принадлежит ПЕРВИЧНОЙ структуре.
| | Строение обуславливает свойства белка.
Денатурация белка, или сворачивание, разрушение вторичной, третичной, четвертичной структур белка под действием внешних факторов: температура, механическое воздействие, химические реагенты.
Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых групп, облегчается воздействие на белки протеолитических ферментов, а, следовательно, он легче гидролизуется.
Разрушение третичной структуры белка- обратимый процесс. При этом возможна ренатурация- восстановление структуры. Например, белков мышц: они постоянно меняют свою структуру, обеспечивая подвижность мышц. Согнули сустав – денатурация, разогнули – обратный процесс ренатурация.
Не все белки способны к обратному процессу: у большинства денатурация необратима.
Гидролиз белка- расщепление белка до аминокислот.
Белки – основной продукт питания. Средняя потребность человека в белке за сутки составляет 80-100 г. Много белка содержат: икра – 26,7%, мясо – 13-14%, рыба – 13-18%, горох – 22%.
При гидролизе белка в желудке в кислой среде образуется смесь аминокислот, которые идут на построение белков каждого конкретного организма, учитывая его индивидуальные потребности.
| | Качественные реакции на белки.
1. Биуретовая реакция доказывает наличие пептидной связи.
К раствору белка добавляют раствор гидроксида натрия и раствор сульфата меди(II) - получается фиолетовое окрашивание.
2. Ксантопротеиновая реакция доказывает наличие ароматических радикалов.
К раствору белка добавляют по каплям концентрированный раствор азотной кислоты. Осторожно нагревая пробирку, наблюдаем изменение цвета с белого на желтый и при добавлении раствора аммиака до оранжевого.
3. Горение белка.
Белки горят с образованием углекислого газа, воды, азота и некоторых других веществ.
Белки, в составе которых есть сера, горят со специфическим запахом – «запах жженого пера», из-за выделения сернистого газа, который мы ощущаем при горении спички.
Благодаря этой реакции можно определить натуральность шелковой и шерстяной нитей.
| | Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации.
|
|
Поиск по сайту:
|
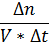 то получим математическое выражение скорости химической реакции в указанном промежутке времени. Известно, что
то получим математическое выражение скорости химической реакции в указанном промежутке времени. Известно, что
 Тогда, если заменить
Тогда, если заменить  молярной концентрацией, получается выражение:
v = ±
молярной концентрацией, получается выражение:
v = ±  Из чего следует определение:
Cкорость химической реакции – это величина, которая равна отношению изменения молярной концентрации вещества к интервалу времени, в течение которого произошло данное изменение.
Измеряется скорость химической реакции чаще всего в моль/л*с»
Из чего следует определение:
Cкорость химической реакции – это величина, которая равна отношению изменения молярной концентрации вещества к интервалу времени, в течение которого произошло данное изменение.
Измеряется скорость химической реакции чаще всего в моль/л*с»
 График «Изменение скорости химической реакции со временем»
График «Изменение скорости химической реакции со временем»
 Рисунок «Взаимодействие соляной кислоты с цинком, железом и медью»
Рисунок «Взаимодействие соляной кислоты с цинком, железом и медью»
 Текст «Якоб Хендрик Вант-Гофф (1852 – 1911гг) -голландский ученый, один из основателей стереохимии и химической кинетики первый лауреат Нобелевской премии по химии»
Текст «Якоб Хендрик Вант-Гофф (1852 – 1911гг) -голландский ученый, один из основателей стереохимии и химической кинетики первый лауреат Нобелевской премии по химии»
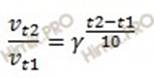 vt2 – скорость реакции при более высокой температуре t2,
vt1 - скорость реакции при более низкой температуре t1?
γ - температурный коэффициент, который показывает во сколько раз увеличится скорость реакции с повышением температуры на 10оС»
vt2 – скорость реакции при более высокой температуре t2,
vt1 - скорость реакции при более низкой температуре t1?
γ - температурный коэффициент, который показывает во сколько раз увеличится скорость реакции с повышением температуры на 10оС»
