- по природе или виду лигандов:
1.Аммиакаты (NH3)
2.Аква-комплексы (H2O)
Ацидо – остатки кислот
4.Хелаты - также внутрикомплексные или циклические комплексные соединения — клешневидные комплексные соединения, образуются при взаимодействии ионовметаллов с полидентатными (то есть имеющими несколько донорных центров) лигандами.
5.Двойные соли– это кристаллические комплексные соединения, образованные из простых солей и имеющие малоустойчивую внутреннюю сферу. Часто формулу двойной соли обозначают перечислением формул простых солей, разделяя их точкой. Например, соль К2[CuCl4] представляют формулой CuCl2•2KCl. Такая формула не означает смеси двух солей! Двойные соли образуют отдельную область среди комплексных соединений (квасцы - двойными солями сульфатов калия, натрия, алюминия, железа, хрома и аммония).
6.Полиядерные (несколько центральных атомов) – кластеры (связь Ме-Ме).
{Mn2(CO)10} -> (CO)5Mn-Mn(CO)5
7.Гидроксокомплексы (гидраты) (ОН-)
8.Смешанные комплексы –Co{(NH3)5Cl}Cl
9.Карбонилы (СО)
-по заряду внутренней сферы:
1.полоительно заряженные комплексы {CoCl2H2O(NH3)3}+
2.Отрицательно заряженные комплексы {PtCl4(OH)2}-
3.Нейтрально заряженные комплексы {Co(NO2)3(NH3)3}0
Номенклатура комплексных соединений:
1.Сначала называют анион, потом катион.
2.если комплекс заряжен нейтрально, то комплексообразователь называют по-русски в И.п.
3.если комплекс заряжен положительно, то комплексообразователь называют по-русски в Р.п., с указанием степени окисления комплексообразователя в круглых скобках римскими цифрами.
4.Если комплекс заряжен отрицательно, то комплексообразователь называют по-латыни в Р.п. с добавлением окончания –ат, с указанием степени окисления КО в круглых скобках римскими цифрами.
5.В названии координационной сферы перечисляют все её составные части (с права на лево); сначала называют кол-во лигандов, сами лиганды и КО.
6.Если комплексная соль содержит разные лиганды в своём составе, то сначала называют (с права на лево) отриц., нейтральные, потом положительно заряженные лиганды. Количество лигандов перечисляется с использованием греческих приставок.
K4[Fe(CN)6] – гексацианоферрат(II) калия;
[Zn(NH3)4Cl2] – дихлоротетраамминцинк;
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди(II).
Химия элементов.
(Электронное строение атома элемента, валентные возможности, положение в таблице элементов. Простые вещества, их физические и химические свойства. Важнейшие соединения, их свойства.)
Водород.
Первый элемент периодической системы – водород. Электронная конфигурация 1s1. Существует в виде трёх изотопов: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T). Возможные степени окисления (СО): -1, 0, +1. Он имеет в большинстве соединений степень окисления +1, но это единственное, что он имеет общего с щелочными металлами, образующими IA группу. В соединениях с щелочными и щелочно-земельными металлами степень окисления водорода равна -1, но это, пожалуй, тоже единственное свойство, которое сближает его с галогенами. Особые св-ваН2связаны с тем, что при ионизации атома Н2 образ-ся протон.
Простое вещество представлено двухатомной молекулой Н2(атомысоединены ковалентной неполярной связью), устойчивой во всех агрегатных состояниях водорода. Молекулы Н2удерживаются в твердом и жидком состояниях только за счет слабых дисперсионных взаимодействий, поэтому Н2 имеет очень низкие tплавления и кипения.Простое веществоН2бесцветныйгаз, гораздо легче воздуха. В смеси с воздухом или кислородомгорюч и взрывоопасен. Малорастворим как в полярных, так и в неполярных растворителях. Водород растворяется в некоторых металлах. Палладий и ванадий поглощают водород при комнатной температуре. Остальные металлы поглощают водород при нагревании.
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия. Поэтому при обычных температурах Н2реагирует только с очень активными металлами, образуя гидриды:2Na + H2 → 2NaH,Ca + H2 → CaH2,Mg + H2 → MgH2
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 + 2Н2 = 2Н2ОN2 + 3H2 → 2NH3 (t, p., кат.)
Взаимодействие с серой - обратимый процесс; при температуре около 200 0С (водород пропускается в расплавленную серу) образуется преимущественно сероводород, при более высокой температуре идет заметное разложение сероводорода:
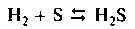
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:C + 2H2 → CH4
Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2OFe2O3 + 3H2 → 2Fe + 3H2OWO3 + 3H2 → W + 3H2O
Восстанавливает металлы из растворов солей:
2AgNO3 + H2 -> 2Ag + 2HNO3
Водород образует множество соединений, химия которых обычно рассматривается в разделах, посвященных элементам, образующим эти соединения. Одним из важнейших соединений водорода является водаH2O.
Молекула имеет угловое строение с валентным углов в 104,50. Атомы в молекуле связаны ковалентными полярными связями. Молекула в целом полярна – диполь. Вода – жидкость без цвета, вкуса и запаха. В природе встречается в 3х агрегатным состояниях. У воды очень высокая теплоёмкость. Вода – универсальный растворитель.
Взаимодействие с активнымиМе:
Взаимодействие а менее активными Ме при нагревании:
Вода – амфотерный, очень слабый электролит, поэтому она не проявляет выраженных кислотных или основных свойств, но оказывает сильное ионизирующее действие на растворённые в ней электролиты. Н2О<->H+ + OH-
Гидратация основных и кислотных оксидов:
Гидратация органических соединений: Вода присоединяется к непредельным углеводородам по месту разрыва кратной связи. Для несимметричных молекул этот процесс подчиняется правилу Марковникова.
Гидролиз солей:
Гидролиз карбидов, нитрилов, гидридов:
Пероксид водорода.
Пероксид водорода, H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Молекула сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается: 2H2O2 → 2H2O + O2
Однако очень чистый пероксид водорода устойчив.
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
Н2O2 + 2NaOH → Na2O2 + 2H2O
H2O2 + Ba(OH)2 → BaO2↓ + 2H2O
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:

В реакции с нитритом калия соединение служит окислителем:
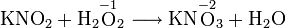
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например: Н2О2 + 2KI + H2SO4 = I2 + K2SO4 + 2H2O
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2O
Получение[править | править исходный текст]
В промышленности[править | править исходный текст]
· Конверсия с водяным паром при 1000 °C:

· Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:

· Электролиз водных растворов солей:

· Каталитическое окисление кислородом:

· Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории[править | править исходный текст]
· Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:

· Взаимодействие кальция с водой:
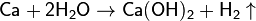
· Гидролиз гидридов:

· Действие щелочей на цинк или алюминий:


· С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:

Кислород.
Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементовД. И. Менделеева, с атомным номером 8. Обозначается символом O. Электронная конфигурация: [He] 2s2 2p4. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое веществокислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета. Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода в форме равнобедренного треугольника (формула O3). Кислород способен образовывать две ковалентные связи с атомами других элементов. Наличие неподелённых пар электронов позволяет образовывать связи по донорно-акцептороному механизму.
Химические свойства кислорода и озона.
Взаимодействие с Ме:
С щелочными Ме (кроме Li) образует пероксиды и надпероксиды:
Непосредственно не реагирует с серебром, золотом, платиной.
С мение активными Ме образует оксиды:
Взаимодействие с неМе:
Экзотермические реакции сопровождаются выделением тепла и света. Это реакции горения:
Взаимодействие со сложными веществами:
Сгорают практически все органические в-ва –
При реакции с водородными соединениями неМе продукты реакции зависят от условий проведения реакции:
Под действием кислорода низшие оксиды и гидроксиды переходят в соответствующие соединения с более высокой степенью окисления:
Озон более сильный окислитель, чем кислород.
Качественная реакция для обнаружения озона:
Признак реакции- в раствор добавляют крахмал, который даёт комплексное соединение синего цвета.
Сера.
СЕРА, S, химический элемент с атомным номером 16. Сера расположена в VIA группе периодической системы Д. И. Менделеева, в 3-м периоде, и принадлежит к числу халькогенов. Конфигурация внешнего электронного слоя 3s23p4. Наиболее характерны степени окисления в соединениях –2, +4, +6 (валентности соответственно II, IV и VI). Сера относится к числу неметаллов. В свободном виде сера представляет собой желтые хрупкие кристаллы или желтый порошок. Сера имеет способность образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде, скипидаре.
Галогены.
Химические элементы главной подгруппы VII группы таблицы Менделеева.Реагируют почти со всеми простыми веществами, кроме некоторых неме. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. Высшая валентностьVII. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I− уменьшается.К галогенам относятся фтор F, хлорCl, бромBr, иод I, астатAt. Фтор — зеленовато-жёлтый газ, очень ядовит и реакционноспособен, попытка получить в свободном виде в больших количествах чревата последствиями.Хлор — зеленоватый газ. Тяжёлый, также очень ядовитый, имеет характерный неприятный запах (запах хлорки).Бром — красно-бурая жидкость. Ядовита. Поражает обонятельный нерв. Очень летуч, поэтому содержится в запаянных ампулах.Иод — фиолетово-чёрные кристаллы. Очень легко возгоняется (пары фиолетового цвета). Ядовит.Астат — сине-чёрные кристаллы. Очень радиоактивен, поэтому о нём сравнительно мало известно. 7 группа А. Неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. Могут быть и восстановителями (кроме F) при взаимодействии с более электроотрицательными элементами.
Азот.
Азот — элемент главной подгруппы пятой группы второго периода периодической системы химических элементовД. И. Менделеева, с атомным номером 7. Простое веществоазот — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха. Азот в свободном состоянии существует в форме двухатомных молекул N2, с тройной связью между молекулами азота N≡N.СО: −3, −2, −1, +1, +2, +3, +4, +5. Валентные возможности – IIIи IV.
Фосфор.
ФОСФОР (лат.Phosphorus) P, хим. элемент V гр. периодической системы; ат. номер 15, Конфигурация внеш. электронной оболочки атома 3s23p3; степени окисления -3, +3 и +5.Является окислителем, но может быть и восстановителем. Высшая валентность V. Известно св. 10 модификаций фосфора, из них важнейшие - белый, красный и черный фосфор. Красный фосфор: твёрдое вещество, без запаха, не ядовитое, устойчивое. Белый фосфор: имеет чесночный запах, летуч, в темноте светится, ядовит. Чёрный фосфор: имеет запах, похож на графит, устойчив. Все модификации не растворяются в воде и органических растворителях.
Углерод (неорганические соединения).
Углерод (C)2s2 2p2 С.О: 4, 3, 2, 1, 0, -1, -2, -3, -4 химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6. Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовыватьхимические связи разного типа.Алмаз: очень твёрдое прозрачное кристаллическое вещество. Атомная кристаллическая решётка тетраэдрического строения. Атомы углерода находятся в состоянии sp3-гибридизации, все связи С-С равны.Графит: мягкое темно-серое вещество с металлическим блеском. Атомная кристаллическая решётка имеет слоистое строение. Высокая электро- и теплопроводность. Слои графита слабо связаны между собой за счёт межмолекулярных сил и легко отделяются друг от друга.
При обычной температуре углерод проявляет малую химическую активность, которая увеличивается при нагревании. Для углерода характерна ОВ двойственность, но за счёт невысокойэлектроотрицательности окислительные свойства выражены значительно слабее.