Физ свва
Ориентировочные физические характеристики (зависят от состава; при нормальных условиях, если не указано другое):
Плотность:
от 0,68 до 0,85 кг/м³ относительно воздуха (сухой газообразный);
400 кг/м³ (жидкий).
Температура самовозгорания: 650 °C;
Взрывоопасные концентрации смеси газа с воздухом от 5 % до 15 % объёмных;
Удельная теплота сгорания: 28—46 МДж/м³ (6,7—11,0 Мкал/м³)[1];
Октановое число при использовании в двигателях внутреннего сгорания: 120—130.
Легче воздуха в 1,8 раз, поэтому при утечке не собирается в низинах, а поднимается вверх[2].
Применение
Природный газ широко применяется в качестве горючего в жилых, частных и многоквартирных домах для отопления, подогрева воды и приготовления пищи; кактопливо для машин (газотопливная система автомобиля), котельных, ТЭЦ и др. Сейчас он используется в химической промышленности как исходное сырьё для получения различных органических веществ, например, пластмасс. В XIX веке природный газ использовался в первых светофорах и для освещения (применялись газовые лампы)
Приготовление суспензии карбоната кальция в воде
Налить в 2 пробирки по 5мл дистиллированной воды. В пробирку №1 добавить 1мл 0,5%-ного раствора желатина. Затем в обе пробирки внести небольшое количество мела и сильно взболтать.
Поставить обе пробирки в штатив и наблюдать расслаивание суспензии. Одинаково ли время расслаивания в обеих пробирках? Какую роль играет желатин? Что является в данной суспензии дисперсной фазой и дисперсионной средой?
Билет №3
Ковалентная связь образуется за счет перекрывания электронных облаков двух атомов. Каждый атом предоставляет один неспаренный электрон для образования одной химической связи, при этом происходит образование общей электронной пары. Если ковалентная связь образуется между двумя одинаковыми атомами, она называется неполярной.
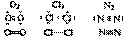
Если ковалентная связь образуется между двумя различными атомами, общая электронная пара смещайся к атому с большей электроотрицательностью (электроотрицательностью называется способность атома притягивать электроны). В этом случае возникает полярная ковалентная связь.

Частным случаем ковалентной связи является донорно-акцепторная связь. Для ее образованья у одного атома должна быть свободная орбиталь на внешнем электронном уровне, а у другого — пара электронов. Один атом (донор) предоставляет другому (акцептору) свою электронную пару, в результате она становится общей, образуется химическая связь. Пример — молекула СО:
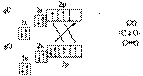
Ионная связь образуется между атомами с сильно отличающейся электроотрицательностью. При этом один атом отдает электроны и превращается в положительно заряженный ион, а атом, получивший электроны, в отрицательно заряженный. Ионы удерживаются вместе за счет сил электростатического притяжения.

Водородная связь образуется между полярными молекулами (вода, спирты, аммиак) за счет притяжения разноименных зарядов.

Прочность водородной связи существенно (~20 раз) меньше, чем ионной или ковалентной связи.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельныеуглеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2— «аллил».
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином). При нормальных условиях - бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен — самое производимое органическое соединение в мире[1]; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год[2]. Наркотик. Класс опасности - четвёртый
Разбавленные кислоты реагируют с металлами, стоящими слева от водорода в ряду напряжения металлов с образованием соли и водорода, например, при взаимодействии серной кислоты с цинком образуются сульфат цинка и водород:
Zn + H2SO4 = ZnSO4 + H2
Растворы кислот взаимодействуют с основными оксидами с образованием соли и воды, например, при взаимодействии серной кислоты с оксидом меди(II) образуются сульфат меди(II) и вода:
H2SO4 + CuO = CuSO4 + H2O
Все кислоты взаимодействуют с основаниями с образованием соли и воды, например: при взаимодействии серной кислоты с гидроксидом натрия образуются сульфат натрия и вода:
2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
2OH- + 2H+ = 2H2O.
Гидроксид меди(II) растворяется в серной кислоте с образованием сульфата меди(II) и воды:
Cu(OH)2 + H2SO4 = Cu SO4 + 2H2O
Cu(OH)2 + 2H+ + SO42- = Cu2+ + SO42- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
Кислоты вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца (выпадает осадок или выделяется газ), например: при взаимодействии серной кислоты с раствором силиката натрия образуется осадок кремниевой кислоты.
H2SO4 + Na2SiO3 = H2SiO3 + Na2SO4
Реакция протекает за счёт связывания катионов водорода с силикат-ионами.
При взаимодействии соляной кислоты с раствором карбоната натрия выделяется углекислый газ и образуется вода:
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
Реакция протекает за счёт связывания катионов водорода и карбонат-ионов.
Билет №4
Классификация химических реакций.
Химические реакции по изменению числа исходных и конечных веществ подразделяют на:
1. Реакции соединения - реакции, при которых из двух или нескольких веществ образуется одно новое вещество:
NH3 + HCl = NH4Cl
CaO + CO2 = CaCO3
2. Реакции разложения - реакции, в результате которых из одного вещества образуется несколько новых веществ:
C2H5Br = C2H4 + HBr
Hg(NO3)2 = Hg + 2NO2 + O2
3. Реакции замещения - реакции, в результате которых атомы простого вещества замещают в молекулах других веществ:
Zn + CuSO4 = Cu + ZnSO4
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4. Реакции обмена - реакции, в результате которых два вещества обмениваются атомами или группировками атомов, образуя два новых вещества:
CaO + 2HCl = CaCl2 + H2O
KCl + AgNO3 = AgClЇ + KNO3
По обратимости реакции делят на обратимые и необратимые. Реакции, протекающие в двух противоположных направлениях, называются обратимыми, а, соответственно, протекающие только в одном направлении - необратимыми. При необратимых реакций продукты реакции уходят из сферы реакции (выпадают в осадок, выделяются в виде газа), образуются малодиссоциирующее соединения или выделяется большое количество энергии
Полимеризация – реакция образования полимера без образования низкомолекулярных продуктов. В качестве мономера используется молекула, содержащая кратную связь. При полимеризации этилена роль бифункциональной структурной единицы играет двойная связь, которая под влиянием инициатора (например, органического пероксида перикиси бензолоила (C6H5COO)2), легко переходит в радикальное состояние R∙; присоединение радикала создает условия для роста цепи:
 + +  → → 
| инициирование | ||

| рост цепи | ||
Для реакции полимеризации характерны три стадии: инициирование, рост цепи и обрыв цепи:

| обрыв цепи |
Этот тип полимеризации называется радикальным.
Органические полимеры - это разнообразные материалы, обычно получаемые из доступного и дешевого сырья; на их основе получают пластические массы (пластмассы) — сложные композиции, в которые вводят различные наполнители и добавки, придающие полимерам необходимый комплекс технических свойств, а также синтетические волокна.
К ним также относятся: полимеризационные смолы, полиэтилен (высокого, среднего и низкого давления), полипропилен, полистирол, поливинилхлорид, полиакрилаты, каучуки, конденсационные смолы, фенолоформальдегидные смолы, полиэфирные смолы, полиэтилентерефталат, полиамидные смолы, капрон, этант, анид и т.д..
Неорганических полимеров — множество. Отличительным и практически важным свойством многих неорганических полимеров является их термическая и химическая стойкость. Другой отличительной чертой многих неорганических полимеров является их твердость и хрупкость. Это обусловлено наличием пространственной кристаллической структуры и часто высокой долей ионной составляющей химической связи. Влияют и другие особенности природы химических связей углерода С – С и С – Н по отношению к химическим связям других элементов.
Простые вещества многих элементов имеют полимерную структуру. К ним относятся металлы, часть неметаллов. Для элементов главной подгруппы VI группы' (S, Se, Те) характерно образование линейных полимерных цепей.
Качественные реакции
1) SO4 – Сульфат
BaCl2 + H2SO4 = BaSO4 + 2HCl
р р н р
Ba + 2Cl + 2H + SO4 = BaSO4 + 2H + 2Cl
Ba + SO4 = BaSO4 – (белый “творожистый” осадок)
2) AgCl – Хлорид
HCl + AgNO3 = AgCl + HNO3
Р р н р
H + Cl + Ag + NO3 = AgCl + H + NO3
Cl + Ag = AgCl – (белый осадок)
3) CO3 – Карбонат
Ca(NO3)2 + Na2CO3 = CaCO3 + 2NaNO3
p p н p
Ca + 2NO3 + 2Na + CO3 = CaCO3 + 2Na + NO3
Ca + CO3 = CaCO3 – (белый осадок)
Билет№5
Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении.
Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду ссольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость (Схема электролитической диссоциации).
Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы.
1. Электролиты - это вещества, растворы или расплавы которых проводят электрический ток.
2. К электролитам относятся щелочи, растворимые соли и кислоты.
3. В водных растворах электролиты распадаются на ионы.
4. Неэлектролиты - вещества, растворы которых не проводят электрический ток.
5. К неэлектролитам относят простые вещества (металлы и неметаллы), оксиды, большинство органических веществ: углеводороды, спирты, альдегиды, углеводы, простые и сложные эфиры и др.
6. Слабые кислоты: H2S, H2CO3, HF, H2SO3, H2SiO3, органические кислоты
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации 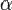 равна отношению числа диссоциированных молекул
равна отношению числа диссоциированных молекул  к сумме
к сумме 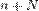 , где
, где  — число недиссоциированных молекул. Часто
— число недиссоциированных молекул. Часто  выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Пример
Для уксусной кислоты CH3COOH величина  равна 4% (в 0,01М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, то есть находятся в виде ионов Н+ и СН3СОО−, остальные же 96 молекул не диссоциированы.
равна 4% (в 0,01М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, то есть находятся в виде ионов Н+ и СН3СОО−, остальные же 96 молекул не диссоциированы.
Поликонденсация — процесс синтеза полимеров из полифункциональных (чаще всего бифункциональных) соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (воды, спиртов и т. п.) при взаимодействии функциональных групп.
Молекулярная масса полимера, образовавшегося в процессе поликонденсации, зависит от соотношения исходных компонентов, условий проведения реакции.
Основные промышленные группы полимеров, синтезируемых поликонденсацией
Линейные полимеры
Полиамиды
Полиуретаны
Поликарбонаты
Полиэфиры
Полисилоксаны
Сетчатые полимеры
Алкидные смолы
Меламин-альдегидные смолы
Мочевино-альдегидные смолы
Фенол-альдегидные смолы
БИЛЕТ 4 ВОПРОС 2
Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций. Здесь мы рассмотрим метод электронного баланса.
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, приэтом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере.
Расставить коэффициенты в реакции, схема которой: HCl + MnO2  Cl2 + MnCl2 + H2O Cl2 + MnCl2 + H2O
|
| Алгоритм расстановки коэффициентов |
1.Указываем степени окисления химических элементов.
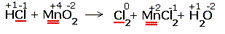 Подчёркнуты химические элементы, в которых изменились степени окисления.
Подчёркнуты химические элементы, в которых изменились степени окисления.
|
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
 За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и передHCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и передHCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:

|
| Рассмотрим более сложное уравнение: |
H2S + KMnO4 + H2SO4  S + MnSO4 + K2SO4 + H2O S + MnSO4 + K2SO4 + H2O
|
Расставляем степени окисления химических элементов:

|
Электронные уравнения примут следующий вид
 Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции
Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции
|
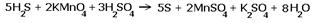
|
Билет №6
Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении.
Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду ссольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость (Схема электролитической диссоциации).
Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы.
Кислоты - это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют:
H2SO4 = 2H+ + SO42−,
HF  H+ + F−
H+ + F−
| Сильные кислоты | HCl, HBr, HI, HClO4, H2SO4, H2SeO4, HNO3, HMnO4, H2Cr2O7 и т.п. |
| Слабые кислоты | HF, H2S, HCN, HClO, HNO2, H3PO4, H2CO3, CH3COOH, H4SiO4 и другие |
Основания - это электролиты, которые при диссоциации поставляют в водный раствор гидроксид-ионы и никаких других отрицательных ионов не образуют:
KOH = K+ + OH−,
Ca(OH)2 = Ca2+ + 2OH−
Диссоциация малорастворимых оснований Mg(OH)2, Cu(OH)2, Mn(OH)2, Fe(OH)2 и других практического значения не имеет.
К сильным основаниям (щелочам) относятся NaOH, KOH, Ba(OH)2 и некоторые другие. Самым известным слабым основанием является гидрат аммиака NH3 · H2O.
Соли - это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме Н+ и любые анионы, кроме OH−:
CuSO4 = Cu2+ + SO42−
BaCl2 = Ba2+ + 2Cl−
KHCO3 = K+ + HCO3−
NaHS = Na+ + HS−
KAl(SO4)2 = K+ + Al3+ + 2SO42−
После растворения и диссоциации средних и кислых солей их катионы и/или анионы могут далее взаимодействовать с водой - подвергаться обратимому гидролизу; за счет последнего процесса в растворах многих солей появляются катионы Н+ и/или анионы OH−.
Оснóвные соли MgCl(OH), Cu2CO3(OH)2 и другие в своем большинстве практически нерастворимы в воде.
Алкадиены — непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2.
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются изолированными. Химические свойства алкадиенов с изолированными двойными связями не отличаются от свойств алкенов с той лишь разницей, что в реакции могут вступать не одна, а две двойные связи независимо друг от друга.
Каучу́ки — натуральные или синтетические эластомеры, характеризующиесяэластичностью, водонепроницаемостью и электроизоляционными свойствами, из которых путём вулканизации получают резины и эбониты.
Вулканизация — технологический процесс взаимодействия каучуков с вулканизующим агентом, при котором происходит сшивание молекул каучука в единую пространственную сетку. При этом повышаются прочностные характеристики каучука, его твёрдость и эластичность, снижаются пластические свойства, степень набухания и растворимость в органических растворителях. Вулканизующими агентами могут являться:сера, пероксиды, оксиды металлов, соединения аминного типа и др. Для повышения скорости вулканизации используют различные ускорители.
Вулканизированные каучуки называют резинами.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇌ 2NH3.
Например, простая реакция
N2O4 ⇌ 2NO2
складывается из элементарных реакций
N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4.
Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии.
Билет №7
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
 ,
,
∆H = -46,2 кДж / моль
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции - выпадают в виде осадка, выделяются в виде газа, например
ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O
2) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка.
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.


Алкины


Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и вреакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
Гомологический ряд алкинов:
Этин: C2H2
Пропин: C3H4
Бутин: C4H6
Пентин: C5H8
Гексин: C6H10
Гептин: C7H12
Октин: C8H14
Нонин: C9H16
Децин: C10H18
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод (промышленный способ)
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:

При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:

Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха.
Химические свойства
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия:
2СН4 = С2Н2↑ + Н2↑
Ацетилен используют:
для сварки и резки металлов,
как источник очень яркого, белого света в автономных светильниках