Классификация оксидов

Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие.
Упражнение на закрепление:
1.
2. Заполнить пропуски:
Неметаллы образуют только __________________оксиды. Металлы образуют ________________, ___________________ и _____________________оксиды. Все оксиды одновалентных металлов являются_________________. Большинство оксидов двухвалентных металлов также являются ____________________. Исключения: ________________________, которые являются __________________.
Большинство оксидов трех – и четырехвалетных металлов являются ____________.
Оксиды металлов с валентностью V, VI, VII являются _________________________.
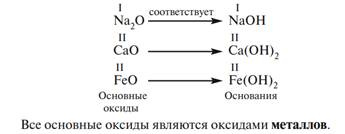
Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксидыметаллов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):
Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn 2O7 - оксид марганца (VII))
Таблица кислородсодержащих кислот и соответствующих кислотных оксидов:
| Кислота (НnА) | Соответствующий кислотный оксид |
| HClO4 хлорная | Cl2O7 оксид хлора (VII) |
| H2SO4 серная | SO3 оксид серы (VI), серный ангидрид |
| HNO3 азотная | N2O5 оксид азота (V) |
| HMnO4 марганцевая | Mn2O7 оксид марганца (VII) |
| H2SO3 сернистая | SO2 оксид серы (IV) |
| H3PO4 ортофосфорная | P2O5 оксид фосфора (V) |
| HNO2 азотистая | N2O3 оксид азота (III) |
| H2CO3 угольная | CO2 оксид углерода (IV), углекислый газ |
| H2SiO3 кремниевая | SiO2 оксид кремния (IV) |
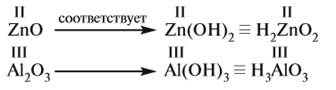
Амфотерные оксиды – это оксиды, которым соответствуют амфотерные гидроксиды (имеют свойства кислот и оснований).
Упражнение на закрепление:
1. Напишите формулы оксидов, которым соответствую следующие основания:
Mg(OH)2, LiOH, Ca(OH)2, Ba(OH)2, NaOH.
2. Из списка выберите элементы, которые образуют кислотные оксиды: сера, фосфор, магний, цинк, углерод, железо. Напишите формулы этих оксидов.
3. Из списка выберите элементы, которые образуют основные оксиды: кальций, хлор, азот, натрий, углерод, кремний, медь. Напишите формулы этих оксидов.
4. Дайте названия оксидам, формулы которых записаны ниже и укажите их характер.
N2O5, CaO, SO3, Al2O3, BaO, ZnO, V2O5, Cr2O3, CuO, SO2, Cu2O, P2O5, MnO2.
Физические свойства оксидов
Цель: изучить физические свойства оксидов
Поагрегатному состоянию оксиды могут быть как жидкостями (Н2О, SO3, Mn2O7), так и газами (СО2, SO2, NO2) или твёрдыми веществами (Al2O3, Fe2O3, K2O, P2O5, SiO2). Оснoвные и амфотерные оксиды, как правило, твёрдые вещества. Кислотные – газообразные, исключение: P2O5, SiO2
По растворимости в воде оксиды делятся на растворимые и нерастворимые. Все кислотные оксиды растворимы, кроме SiO2. Среди основных оксидов растворимыми являются оксиды щелочных металлов и щелочноземельных. Амфотерные оксиды не растворяются в воде.
Оксиды имеют различный цвет. Оксид меди(II) – черного цвета, оксид никеля(II), хрома (III) – зеленого цвета, оксид кальция, цинка и титана – белого цвета, оксид водорода, углерода (IV) – бесцветный.
Получение оксидов

Химические свойства основных оксидов
1. Основные оксиды взаимодействуют с водой с образованием оснований. Непосредственно в реакцию соединения с водой вступают только оксиды щелочных и щелочноземельных металлов:
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2  CaSiO3
CaSiO3
4. Взаимодействие с амфотерными оксидами:
Na2O+ ZnO = Na2ZnO2