Периодический закон д.и. мЕНДЕЛЕЕВА
И электронная структура атомов
Учебное пособие

Астрахань
УДК 540
Периодический закон и электронная структура атомов: Учеб. пособие / Рябухин Ю.И., Огородникова Н.П., Левченков С.И / Астрахан. гос. техн. ун-т. – Астрахань, 2007. – 52 с.
Учебное пособие соответствует государственным образовательным стандартам высшего профессионального образования по дисциплине ″Общая химия″ для нехимических направлений и специальностей.
Ил. 15, табл. 8, библиогр.: 9 назв.
Печатается по решению кафедры «Общая, неорганическая и аналитическая химия» (протокол № 7 от 28 мая 2007 г.)
Рецензент: кандидат химических наук, доцент Старкова Н.Н.
Компьютерный набор и вёрстка: Бурлинов А.А.

© Авторы, 2007
Что часто имеет ещё большее значенье, с какими с какими
И в положенье каком войдут в сочетание те же те же
Первоначала, и как они двигаться будут взаимно взаимно.
Те же начала собой образуют ведь небо и землю, и землю,
Солнце, потоки, моря, деревья, плоды и животных и животных.
Но и смещения их и движения в разном различны различны.
Лукреций * ″О природе вещей″
ВВЕДЕНИЕ
Химики не перестают удивляться простоте и изяществу периодической системы химических элементов** Д.И. Менделеева, будущие специалисты – студенты – сложности и запутанности связей между строением атомов и свойствами химических элементов, школьники – огромному количеству информации, которое уместилось всего на одной странице. Действительно, в каждой клеточке таблицы (а их уже больше сотни) указаны и международный символ химического элемента, и его название, и порядковый номер, и относительная атомная масса… В полных вариантах содержатся и другие сведения: цветом выделяют принадлежность элемента к тому или иному семейству, указывают строение электронных оболочек, приводят свойства простых веществ и тип их кристаллической структуры.
Современный облик таблицы – плод долгого и напряжённого труда тысяч и тысяч химиков и физиков. Д.И. Менделеев вполне мог бы повторить слова английского учёного Дж. У. Меллора, который по окончании многолетней работы над своей 16-томной энциклопедией по неорганической и теоретической химии написал на титульном листе: "Посвящается рядовым огромной армии химиков. Их имена забыты, их труд остался …"
За всю историю существования периодической системы было предложено большое количество (более 500) вариантов её графического изображения, преимущественно в виде таблиц, а также в виде различных геометрических фигур (пространственных и плоскостных), аналитических кривых (спиралей и пр.) т. д. Наибольшее распространение получили четыре вида таблиц: короткая, полудлинная, длинная и лестничная (пирамидальная) (рис. 2-5).
"Вероятно, это самый компактный и полный значения сгусток знания, когда-либо изобретённый человеком", – так сказал знаменитый американский астроном Харлоу Шепли (1885–1972 гг.). Не преувеличил ли её значение человек, далёкий от химических реалий? Ни в коем случае. Разве что прилагательное "изобретённый" выбрано не очень удачно. Периодическую систему нельзя было изобрести. Её можно было только разработать, поскольку она является естественной классификацией химических элементов и уникальным "банком данных", содержащим богатейшую информацию о свойствах химических элементов, формах их соединений, закономерностях построения электронных конфигураций атомов. Периодическая система элементов Д.И. Менделеева – это графический (табличный) "образ" периодического закона, не имеющего количественного выражения в виде какой-либо общей математической формулы или уравнения.
1. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Систематическое изложение химических
фактов для начинающих во многих отношениях
выигрывает от применения периодического закона.
К этому убеждению я пришёл на своих лекциях…
Д. И. Менделеев
Историческая справка
Систематизация элементов. Периодический закон
Одной из важнейших проблем теоретической химии XIX в. после разрешения проблемы атомных весов оставалась систематизация химических элементов. Со времен античности и средних веков были известны 14 элементов (хотя собственно элементами их стали считать лишь в конце XVIII в.). В XVIII в. к ним добавляется 19 новых элементов; к 1860 г. число элементов возрастает до шестидесяти. Проблема упорядочения элементов и отыскания закономерности в изменении их свойств становится весьма актуальной.
Первую попытку систематизации элементов предпринимает немецкий химик Иоганн Вольфганг Дёберейнер (1780-1849), сформулировавший в 1829 г. закон триад. Дёберейнер обратил внимание на то, что в рядах сходных по свойствам элементов наблюдается закономерное изменение атомной массы. В выделенных Дёберейнером триадах элементов атомный вес среднего элемента триады примерно равен полусумме атомных весов двух крайних элементов:
| Cl | S | P | Ca | Li |
| Br | Se | As | Sr | Na |
| I | Te | Sb | Ba | K |
Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.
В 1843 г. Леопольд Гмелин привел таблицу химически сходных элементов, расставленных по группам в порядке возрастания ″соединительных масс″. Вне групп элементов, вверху таблицы, Гмелин поместил три ″базисных″ элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады (группы из четырех и пяти элементов), причём под кислородом расположены группы металлоидов (по терминологии Берцелиуса), то есть электроотрицательных элементов. В таблице Гмелина электроположительные и электроотрицательные свойства групп элементов плавно изменялись сверху вниз. Несколько вариантов таблиц предложил в 1857-1868 гг. английский химик Уильям Одлинг (1829-1921).
Александр Эмиль Бегуйе де Шанкуртуа (1820-1886) в 1862 г. предложил винтовой график элементов, расположенных в порядке возрастания атомных весов – так называемая ″земная спираль″ (vis tellurique). Шанкуртуа нанёс на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие элементам. Таким образом, элементы, атомные веса которых отличались на 16 или на число, кратное 16, располагались на одной вертикальной линии. При этом точки, отвечающие сходным по свойствам элементам, часто оказываются на одной прямой. Винтовой график Шанкуртуа фиксирует закономерные отношения между атомными массами элементов, однако данная система не могла быть признана удовлетворительной.
Джон Александр Рейна Ньюлендс (1837-1898) в 1864 публикует таблицу элементов, отражающую предложенный им закон октав. Ньюлендс показывает, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер (табл. 1).
Таблица 1
Таблица Ньюлендса, 1864 г.
| № | № | № | № | № | № | № | № | ||||||||
| H | F | Cl | Co Ni | Br | Pd | I | Pt Ir | ||||||||
| Li | Na | K | Cu | Rb | Ag | Cs | Tl | ||||||||
| Be | Mg | Ca | Zn | Sr | Cd | Ba V | Pb | ||||||||
| B | Al | Cr | Y | Ce La | U | Ta | Ti | ||||||||
| C | Si | Ti | In | Zr | Sn | W | Hg | ||||||||
| N | P | Mn | As | Di Mo | Sb | Nb | Bi | ||||||||
| O | S | Fe | Se | Rh Ru | Te | Au | Th |
В таблице Ньюлендса сходные элементы располагаются в горизонтальных рядах, однако в том же ряду оказываются и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест. Вследствие присущих системе Ньюлендса недостатков современники отнеслись к закону октав чрезвычайно скептически.
В том же году Уильям Одлинг, пересмотрев предложенную им в 1857 г. систематику элементов, основанную на эквивалентных весах, предлагает следующую таблицу, не сопровождаемую какими-либо пояснениями (табл. 2).
Таблица 2
Таблица Одлинга, 1864 г.
| Триплетные группы | ||||
| H 1 | Mo 96 | W 184 | ||
| Au 196,5 | ||||
| Pd 106,5 | Pt 197 | |||
| Li 7 | Na 23 | – | Ag 108 | |
| G 9 | Mg 24 | Zn 65 | Cd 112 | Hg 200 |
| B 11 | Al 27,5 | – | – | Tl 203 |
| C 12 | Si 28 | – | Sn 118 | Pb 207 |
| N 14 | P 31 | As 75 | Sb 122 | Bi 210 |
| O 16 | S 32 | Se 79,5 | Te 129 | |
| F 19 | Cl 35 | Br 80 | I 127 | |
| K 39 | Rb 85 | Cs 133 | ||
| Ca 40 | Sr 87,5 | Ba 137 | ||
| Ti 40 | Zr 89,5 | – | Th 231 | |
| Cr 52,5 | V 138 | |||
| Mn 55 и др. (Fe, Ni, Co, Cu) |
Следующий этап связан с исследованиями, которые проводил в 60-е гг. XIX в. немецкий химик Юлиус Лотар Мейер (1830-1895) (табл. 3).
Таблица 3
Таблица Мейера, 1864 г. (фрагмент)
| 4Val | 3 Val | 2 Val | 1 Val | 1 Val | 2 Val |
| C = 12 | N = 14,4 | O = 16 | F = 19 | Na = 23 | Mg = 24 |
| Si = 28,5 | P = 31 | S = 32 | Cl = 35,5 | K = 39 | Ca = 40 |
| … | As = 75 | Se = 78,8 | Br = 80 | Rb = 85,4 | Sr = 87 |
| Sn = 117,6 | Sb = 120,6 | Te = 128,3 | I = 126,8 | Cs = 133 | Ba = 137,4 |
| Pb = 207 | Bi = 208 | … | … | (Tl = 204) | … |
В 1864 г. Мейер публикует первую таблицу, в которую включены 42 элемента (из 63), размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничивает число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах подобных элементов,
В 1870 г. выходит работа Мейера, содержащая новую таблицу и график зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид (рис. 1).
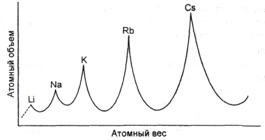
Рис. 1. Кривая атомных объёмов Мейера
Предложенная Мейером таблица ″Природа элементов как функция их атомного веса″ состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Мейер оставил незаполненными (табл. 4).
Таблица 4
Таблица Мейера, 1870 г.
| I | II | III | IV | V | VI | VII | VIII | IX |
| B | Al | In (?) | Tl | |||||
| C | Si | Ti | Zr | Sn | Pb | |||
| N | P | V | As | Nb | Sb | Ta | Bi | |
| O | S | Cr | Se | Mo | Te | W | ||
| F | Cl | Mn Fe Co Ni | Br | Ru Rh Pd | I | Os Ir Pt | ||
| Li | Na | K | Cu | Rb | Ag | Cs | Au | |
| Be | Mg | Ca | Zn | Sr | Cd | Ba | Hg |
В марте 1869 г. русский химик Дмитрий Иванович Менделеев (1834-1907) представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях:
1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств.
2. Сходные по свойствам элементы имеют или близкие атомные веса (Os, Ir, Pt), или последовательно и однообразно увеличивающиеся (К, Rb, Cs).
3. Сопоставление элементов или их групп по величине атомного веса отвечает их валентности.
4. Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами.
5. Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента.
6. Следует ожидать открытия ещё многих неизвестных элементов, например, сходных с А1 или Si, с паем (атомной массой) 65–75.
В 1869 г. выходит первое издание учебника ″Основы химии″ с приведённой первой периодической таблицей Менделеева (рис. 2).
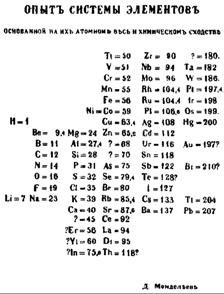
Рис. 2. "Опыт системы элементов, основанной на их атомном
весе и химическом сходстве".
Таблица опубликована Д.И. Менделеевым отдельным
изданием 17 февраля (1 марта по новому стилю) 1869 г.
В конце 1870 г. Менделеев докладывает РХО статью ″Естественная система элементов и применение её к указанию свойств неоткрытых элементов″, в котором предсказывает свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций).
В 1871 г. Менделеев в итоговой статье ″Периодическая законность химических элементов″ даёт формулировку Периодического закона: ″ Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса ″. Тогда же Менделеев придает своей периодической таблице классический вид (так называемая короткая таблица) (табл. 5).
В связи с периодической таблицей химических элементов часто поднимается вопрос о приоритете. Здесь следует чётко отделять периодическую таблицу и периодический закон химических элементов, В таблицах Одлинга 1864 г., Менделеева 1869 г. и Мейера 1870 г. нельзя не отметить несомненного сходства; во всех таблицах оставлены места для неоткрытых элементов и все они не лишены недостатков.
Работа Мейера была сдана в печать в 1869 г.; после выхода работ Менделеева Мейер добавил в свою статью ссылку на Менделеева, где, в частности, особо указал, что предлагаемый им график прекрасно иллюстрирует предложенный Менделеевым термин ″ периодичность ″. Таким образом, поскольку Менделеев и Мейер независимо друг от друга предложили весьма близкие варианты таблицы, используемое в некоторых странах название ″таблица Менделеева-Мейера″ можно считать не лишённым оснований.
Вместе с тем приоритет Менделеева в открытии периодического закона химических элементов является совершенно неоспоримым (сам Мейер на него никогда и не претендовал). Мейер, Шанкуртуа, Ньюлендс и Одлинг систематизировали элементы, указывая на наличие несомненной закономерности в численных величинах атомных весов. Однако никто до Менделеева не решился счесть эти закономерности общим законом природы. Заслуга Менделеева состоит в том, что он не просто расположил элементы в определённом порядке, но взял на себя смелость на основании предположения, что именно атомная масса предопределяет свойства элемента, изменить принятые атомные веса некоторых элементов и подробно описать свойства неоткрытых ещё элементов. Сам Менделеев по этому поводу высказался следующим образом: ″ Утверждение закона возможно только при помощи вывода из него следствий, без него невозможных и не ожидаемых, и оправдание тех следствий в опытной проверке. Потому-то, увидев периодический закон, я со своей стороны вывел из него такие логические следствия, которые могли показать – верен ли он или нет. Без такого способа испытания не может утвердиться ни один закон природы ».
Таблица 5
| VIII | Fe = 56, Co = 59, Ni = 59, Cu = 63 | Ru = 104, Rh = 104, Pd = 106, Ag = 108 | – 150 – 151 – 152 – 153 | Os = 193, Ir = 195, Pt = 197, Au = 197 | ||||||||
| VII | F = 19 | Cl = 35,5 | Mn = 55 | Br = 80 | – 100 | I = 127 | – 148 | – 168 | – 190 | – 212 | ||
| VI | O = 16 | S = 32 | Cr = 52 | Se = 78 | Mo = 96 | Te = 125 | – 146 | – 166 | W = 182 | – 210 | U = 240 | |
| V | N = 14 | P = 31 | V = 51 | As = 75 | Nb = 94 | Sb = 122 | – 142 | – 164 | Ta = 182 | Bi = 208 | – 227 | |
| IV | C = 12 | Si = 28 | Ti = 48 | – 72 = Es | Zr = 90 | Sn = 118 | Ce = 140 | – 162 | La = 180? | Pb = 207 | Th = 231 | |
| III | B = 11 | Al = 27 | – 44 = Eb –? | – 68 = El? | Yt = 88? | In = 113 | Di = 138? | – 160 | Er = 178? | Tl = 204 | – 227 | |
| II | Be = 9,4 | Mg = 24 | Ca = 40 | Zn = 65 | Sr = 87 | Cd = 112 | Ba = 137 | – 158 | – 175 | Au = 197 | – 220 | |
| Группа I | H = 1 | Li = 7 | Na = 23 | K = 39 | Cu = 63 | Rb = 85 | Ag = 108 | Cs = 133 | – 153 | – 175 | Au = 197 | – 220 |
| Ряд 1 | Ряд 2 | Ряд 3 | Ряд 4 | Ряд 5 | Ряд 6 | Ряд 7 | Ряд 8 | Ряд 9 | Ряд 10 | Ряд 11 | Ряд 12 |
Формулировка Менделеевым периодического закона и построение периодической таблицы означали лишь начало развития учения о периодичности свойств элементов. Предсказания Менделеева вначале были встречены с известным скепсисом; лишь после того, как были открыты предсказанные элементы и обнаружено совпадение их реальных свойств с предсказанными, периодический закон был признан в качестве одного из фундаментальных законов химии. В развитии периодического закона принято выделять два этапа – химический и физический.