В 1869 г. тридцатипятилетний профессор Санкт-Петербургского университета Д. И. Менделеев открыл закон периодического изменения свойств химических элементов – основополагающий закон природы вообще и фундамент всей химии элементов в частности – и создал периодическую систему химических элементов (рис. 2).
Окончательная формулировка периодического закона была дана Менделеевым в июле 1871 г. Она гласила: "Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов".
Открытие периодического закона было сделано в то время, когда атом считался неделимой частицей, и было известно только 63 химических элемента. Спустя 40 лет, когда началась разгадка тайны строения атомов, путеводной нитью в этих работах служила периодическая система Д.И. Менделеева, так как оказалось, что химические элементы в ней размещены в соответствии с электронным строением их атомов, а заряд ядра атома (выраженный в единицах заряда протона) численно равен порядковому номеру соответствующего элемента в Периодической системе (закон Мозли*, 1913 г.). И это при том, что во времена Д.И. Менделеева химические элементы не нумеровались.
Таким образом, был установлен физический смысл порядкового номера химического элемента в Периодической системе, который выражает заряд ядра и количество электронов в электронейтральном атоме.

С современных позиций периодические изменения свойств атомов элементов обусловлены периодическим повторением с определённой закономерностью их сходных электронных конфигураций. И поэтому современная формулировка периодического закона Д.И. Менделеева такова: "Свойства химических элементов, образуемых ими простых и сложных веществ, находятся в периодической зависимости от зарядов ядер атомов и определяются периодически повторяющимися электронными конфигурациями атомов.
Периодическая система химических элементов, представленная Д. И. Менделеевым в виде таблицы, – это наглядное отражение периодического закона. При изучении химии используются три формы периодической системы, которые получили наибольшее распространение: короткая (8 клеточная*, рис. 4), полудлинная (18 клеточная, рис. 5) и длиннопериодная (32 клеточная, рис. 6), а также лестничная форма (рис. 3).
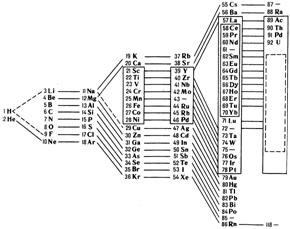
Рис. 3. Лестничная (пирамидальная) форма Периодической
системы Д.И. Менделеева (по Н. Бору**)
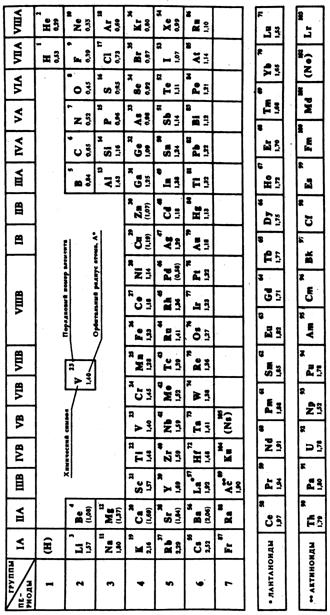
| Рис. 5. Полудлинная форма периодической системы Д.И. Менделеева (18 клеточная) |
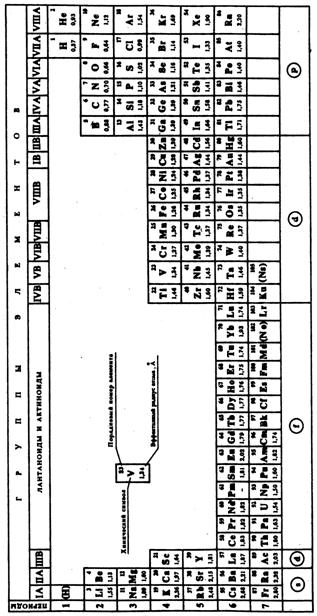
| Рис. 6. Длиннопериодная форма периодической системы Д.И. Менделеева (32 клеточная) |
Иногда меня спрашивают, как можно быть уверенным, что где-то во Вселенной не существует большего числа элементов, чем в периодической системе. Пытаясь ответить на этот вопрос, я говорю, что он подобен вопросу – откуда известно, что где-нибудь во Вселенной не существует ещё одного целого числа между 4 и 5? К сожалению, кое-кому кажется, что это тоже разумный вопрос.
Джордж Уальд (1964 г)