Атомов элементов
Атомам каждого элемента присущи характерные для них степени окисления, которые связаны с положением элемента в периодической системе.
Высшая степень окисления атомов элементов главных подгрупп (А-групп) в каждом периоде обычно возрастают от +1 до +7.
Металлы I-III групп периодической системы образуют положительные ионы, заряд которых равен номеру группы химического элемента; таким образом, степень окисления непереходных металлов совпадает с номером их группы.
У неметаллов часто обнаруживаются по две характерные степени окисления. Их низшая степень окисления обычно равна: 8 минус номер группы элемента. Таким образом, каждый атом может соединяться с (8 – номер группы) атомами водорода. Например, один атом серы (VI группа) соединяется с двумя атомами водорода с образованием сероводорода H2S, поскольку имеет степень окисления –2. Высшая степень окисления неметаллов обычно равна номеру группы, особенно в соединениях с кислородом. Например, степень окисления атомов серы в оксиде SO3 и серной кислоте H2SO4 равна +6. Большинство неметаллов, кроме этого, обладает также промежуточными степенями окисления. Например, атомы серы в различных соединениях имеют следующие степени окисления: 0 [самородная (молекулярная) сера S8], +4 (SO2, H2SO3).
У атомов переходных металлов (группы Б) степени окисления подчиняются определённым закономерностям. При окислении переходных металлов их атомы могут терять из валентной электронной оболочки не более двух s-электронов и все неспаренные d-электроны. Поэтому высшая степень окисления для атомов скандия Sc равна +3, и она увеличивается на единицу в каждой следующей группе, достигая максимального значения +7 у атомов марганца Mn. После этого степень окисления вновь уменьшается на единицу у каждого следующего металла (Fe, Co, Ni, Cu) достигая +2 у цинка. Единственным исключением из этого правила является отсутствие степени окисления +5 у атомов Со.
Члены ряда переходных металлов проявляют высшие степени окисления атомов соответствующие в основном номерам групп элементов (например для элементов 4d-ряда: Ag+, Cd2+, Y3+, Zr4+, Nb+5, Mo+6, Tc+7, Ru+8).
У переходных металлов проявляются кроме высших и другие степени окисления, среди которых чаще всего встречаются степени окисления +2 и +3.
Металлы первого переходного ряда, от Sc до Zn, обнаруживают различные степени окисления (рис. 14). Металлы второго и особенно третьего переходных рядов, от Lu до Hg, проявляют только высшие степени окисления.
Каждый переходный элемент в своей низшей степени окисления обладает наиболее выраженными основными свойствами, а в высшей степени окисления они проявляются в минимальной степени. Например, среди оксидов хрома: CrO – оснóвный, Cr2O3 – амфотерный, а CrO3 – кислотный.
Лантаниды и актиниды образуют ряды переходных металлов иного типа, в которых соединения элементов обладают очень сходными свойствами. Для всех лантанидов и актинидов в их соединениях обычно проявляется степень окисления атомов +3. Однако возможны и другие степени окисления, которые являются более характерными для атомов отдельных элементов (например, Eu2+, Ce4+ и U6+).
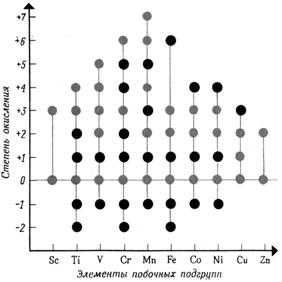
Рис. 14. Степени окисления, характерные для атомов 3d-элементов. (Наиболее часто встречающиеся степени окисления обозначены светлее)
Внутри групп Б, в противоположность группам А, возрастает стабильность соединений, в которых атомы находятся в высших степенях окисления. А это в свою очередь обусловливает то, что многие соединения элементов групп Б (V, Cr, Mn, Fe, Co, Ni, Cu) в водных растворах окрашены. Например: V2О5 – оранжевый, CrО3 – красный, Mn2О7 – зелёный, Fe2О3 – красно-коричневый, CoО – зеленовато-коричневый, NiО – тёмно-зелёный, Cu2О – красный).
Химические свойства элементов групп Б как внутри периода, так и внутри группы меняются в значительно меньшей степени, чем элементов групп А.
Периодичность изменения основных характеристик атомов и простых веществ* элементов главных подгрупп (групп А) представлена в табл. 8.
Таблица 8
Периодичность изменения химических и физических характеристик атомов и простых веществ элементов главных подгрупп
| Характеристика | Изменение | |
| в главных подгруппах | в периодах | |
| Заряд ядра атомов | Увеличивается ↓ | Увеличивается → |
| Восстановительные свойства атомов | Увеличиваются ↓ | Уменьшаются → |
| Окислительные свойства атомов | Уменьшаются ↓ | Увеличиваются → |
| Высшая валентность атомов по отношению к кислороду | Постоянна | Увеличивается I → VII |
| Валентность атомов по отношению к водороду | Постоянна | Увеличивается I → IV←I |
| Плотность простых веществ | В основном увеличивается ↓ | Увеличивается I ← IV →VII |
| Температура плавления и кипения металлов | В основном уменьшается ↓ | |
| Температура плавления и кипения неметаллов | В основном увеличивается ↓ |
ВОПРОСЫДЛЯ САМОКОНТРОЛЯ
1. Чем современная формулировка периодического закона отличается от формулировки Д.И. Менделеева и почему она является более точной?
2. Какие характеристики атомов можно предсказать, зная:
а) порядковый номер элемента в периодической системе Д.И. Менделеева;
б) номер периода;
в) номер и тип группы, в которой расположен химический элемент?
3. Почему число химических элементов в периодах соответствует ряду чисел: 2, 8, 18, 32?
Объясните эту закономерность с позиций энергетического состояния электронов в атомах и их расположения на энергетических уровнях.
4. На каком основании элементы: а) хром и сера; б) фосфор и ванадий расположены в одной группе периодической системы Д.И. Менделеева? Почему эти пары элементов помещают в разных подгруппах?
5. Укажите, как изменяются радиусы атомов в ряду:
а) K, Ca, Sc, Ti; б) O, S, Se, Te?
У атомов каких элементов сильнее выражены окислительные, а у каких – восстановительные свойства?
6. Атомы какого элемента легче отдают электроны:
а) Mg, Ca, Al, Na, K; б) I, Br, Cl, F;
в) Ba, Ca, Mg; г) Mg, S, Cl?
Как изменяются окислительные и восстановительные свойства атомов в этих рядах?
7. Почему энергия ионизации атомов меди меньше энергии ионизации атомов калия?
Каково соотношение этих величин у атомов марганца и хлора?
8. Для атомов углерода значения энергии ионизации (эВ) следующие:
Еи,1 =11,2; Еи,2= 24,4; Еи,3 = 47,9; Еи,4 = 64,5; Еи,5 = 392,0.
Объясните: а) характер изменения энергий ионизации;
б) чем вызван резкий скачок значения Еи,5 .
9. Как изменяются величины сродства к электрону и окислительные свойства атомов в ряду: а) N, O, F; б) S, Se, Te?
10. Как изменяются значения электроотрицательности и восстановительные свойства атомов в ряду: а) Si, N, S; б) Al, B, C; в) Ca, P, Cl, Na?
11. Как изменяются оснóвные свойства в ряду гидроксидов элементов третьего периода?
12. Как изменяются кислотные свойства в ряду оксидов: СО2, SiO2 и GeO2?