Периодический закон имеет исключительно важное значение. Он положил начало современной химии, сделал её единой целостной наукой. Химические элементы стали рассматриваться во взаимосвязи в зависимости от того, какое место они занимают в периодической системе Д.И. Менделеева.
Химия перестала быть описательной дисциплиной, в ней стало возможным научное предвидение. Появилась возможность предсказывать новые элементы и описывать свойства их атомов и химических соединений. Открытия предсказанных Менделеевым элементов галлия, скандия и германия явились блестящим подтверждением истинности периодического закона и способствовали окончательному его признанию научным миром.
На основе периодического закона и периодической системы Д.И. Менделеева быстро развилось учение о строении атома, которое в свою очередь вскрыло физический смысл периодического закона и объяснило расположение химических элементов в периодической системе.
Учение о строении атома привело к открытию атомной энергии и использованию её для нужд человека. Можно без преувеличения сказать, что периодический закон является первоисточником всех открытий химии XX века и многих – физики. Он сыграл выдающуюся роль и в развитии многих смежных с химией естественно-научных дисциплин.
Периодический закон и периодическая система Д.И. Менделеева лежат в основе решения современных задач химической науки и химической промышленности. С учётом периодической системы химических элементов ведутся работы по целенаправленному получению новых полимерных и полупроводниковых материалов, жаропрочных сплавов и веществ с заданными свойствами, использованию ядерной энергии, исследованию недр Земли, Вселенной...
Велико и педагогическое значение периодической системы Д.И. Менделеева, которая служит научной основой преподавания химии в средней и в высшей школе.
Периодический закон – это универсальный закон для всей Вселенной. Он имеет силу везде, где существуют атомы. Но периодически изменяются не только электронные структуры атомов. Строение и свойства атомных ядер также подчиняются своеобразному периодическому закону. В ядрах, состоящих из нейтронов и протонов, существуют нейтронные и протонные оболочки, заполнение которых имеет периодический характер. Известны даже попытки построения периодической системы атомных ядер.
ПЕРИОДИЧНОСТЬ ИЗМЕНЕНИЯ ОСНОВНЫХ
ХАРАКТЕРИСТИК АТОМОВ ЭЛЕМЕНТОВ
Химические свойства атомов элементов наряду с зарядом ядра, числом энергетических уровней и количеством валентных электронов определяются их радиусом, энергией ионизации, сродством к электрону и электроотрицательностью.
Радиус атома
Одной из наиболее важных характеристик атома, влияющих на его химические свойства, является размер, или радиус, атома (rат).
Чем больше радиус атома, тем слабее удерживаются электроны внешних энергетических уровней атомным ядром. И, наоборот, с уменьшением радиуса атома эти электроны притягиваются к атомному ядру сильнее. Однако радиус атома не может быть точно определён, поскольку электронные орбитали не имеют границ. Следовательно, речь может идти не об абсолютных размерах атомов, а только о размерах атомов в кристаллах и молекулах, то есть об эффективных радиусах атомов.
В качестве единицы измерения радиуса атома в настоящее время используют пикометр (1 пм = 10–12 м).
Радиус атома (по Ван-дер-Ваальсу * ) – это половина кратчайшего расстояния, на которое могут сблизиться ядра двух одинаковых атомов, если они принадлежат разным молекулам (рис. 7).

Рис. 7. Радиус атома водорода по Ван-дер-Ваальсу
в молекуле водорода Н2
Радиусы атомов элементов периодически изменяются в зависимости от заряда их ядра и числа электронов (рис. 11).
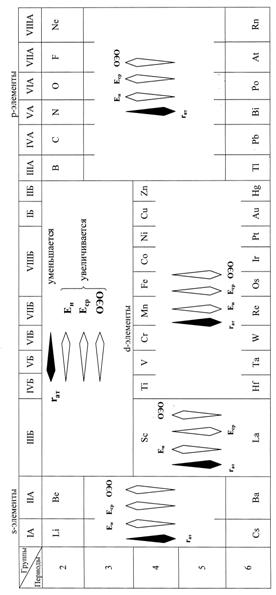
При движении слева направо по периоду радиусы атомов элементов, как правило, уменьшаются, так как при постоянном числе электронных слоёв возрастает заряд атомных ядер, а следовательно, увеличивается и взаимодействие электронов с ядром (в результате электронная оболочка* сжимается) (рис. 8). В меньшей степени уменьшаются радиусы атомов d - и f -элементов, что объясняется заполнением внутренних электронных слоёв и называется это d- и f-сжатием.

| 
| 
| 
| 
| 
| 
| 
|
| Li | Be | B | C | N | O | F | Ne |

| 
| 
| 
| 
| 
| 
| 
|
| Na | Mg | Al | Si | P | S | Cl | Ar |
Рис. 8. Изменение радиусов атомов элементов второго и
третьего периодов
В главных подгруппах периодической системы (А-группах) радиусы атомов, как правило, увеличиваются сверху вниз, так как с ростом порядковых номеров элементов увеличивается и число электронных слоёв (рис. 8). В побочных подгруппах (Б-группах) при переходе от верхнего элемента к среднему атомный радиус также возрастает, однако при переходе от среднего к нижнему элементу возможно даже некоторое его уменьшение (лантанидное сжатие).
Значения атомных объёмов также демонстрируют определённую периодичность; молярный (атомный) объём элемента есть отношение молярной массы простого вещества в твёрдом состоянии (для газов – в жидком состоянии) к его плотности, экстраполированной на 0 К; у щелочных металлов проявляются высшие значения, а у элементов Б-групп – низшие (рис. 9).
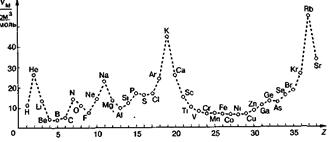
Рис. 9. Молярные атомные объёмы элементов
Энергия ионизации
Важной характеристикой атома, определяющей его способность отдавать электрон, является энергия ионизации (Еи).
Энергия ионизации – это энергия, необходимая для удаления одного моля электронов от одного моля электронейтральных атомов данного элемента и образованием при этом положительно заряженных атомов (катионов).
Различают первую Еи,1, вторую Еи,2 и последующие энергии ионизации, то есть энергии, отвечающие удалению первого, второго и каждого последующего электрона из многоэлектронного атома.
Удаление первого электрона описывается уравнением:
Э + Еи,1 → Э+ + ē,
где Э – электронейтральный атом;
Э+ – положительно заряженный атом (ион);
Еи,1 – первая энергия ионизации, кДж/моль или эВ*.
По мере последовательного удаления электронов положительный заряд образующихся ионов возрастает, и увеличивается взаимодействие электронов с ядром атома. Поэтому для удаления каждого последующего электрона требуется бόльшая энергия (табл. 6):
Э 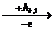 Э+
Э+ 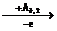 Э2+
Э2+ 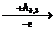 …
… 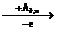 Эn+;
Эn+;
Еи,1 < Еи,2 < Еи,3 … < Еи,n.
Энергия ионизации является функцией заряда ядра и радиуса атомов элементов, а также характера межэлектронного взаимодействия.
Еи = f (Z, r ат, межэлектронное взаимодействие).
При прочих равных условиях энергия ионизации обратно пропорциональна величине радиуса атома, то есть чем дальше электроны находятся от атомного ядра, тем слабее их взаимодействие с ядром.
В многоэлектронном атоме на энергию взаимодействия внешних электронов с атомным ядром оказывает э ффект экранирования, заключающийся в уменьшении воздействия на эти электроны заряда атомного ядра из-за наличия внутренних электронных слоёв. Экранирование, возрастая с увеличением числа внутренних электронных слоёв, ослабляет взаимодействие внешних электронов с атомным ядром. В результате на наиболее удалённые от атомного ядра внешние электроны действует не полный заряд атомного ядра Z, а значительно меньший эффективный заряд Zэф..
Таблица 6
Энергии ионизации атомов s - и p -элементов, эВ
| Атом | Еи,1 | Еи,2 | Еи,3 | Еи,4 | Еи,5 |
| H | 13,6 | ||||
| He | 24,6 | 54,4 | |||
| Li | 5,4 | 75,6 | 122,4 | ||
| Be | 9,3 | 18,2 | 153,8 | 217,7 | |
| B | 8,3 | 25,1 | 37,9 | 259,3 | 340,1 |
| C | 11,2 | 24,4 | 47,9 | 64,5 | 392,0 |
В периоде наименьшую энергию ионизации (способность отдавать наиболее слабосвязанный с атомным ядром электрон) имеют атомы группы IA – атомы щелочных металлов (рис. 10), так как у них во внешнем электронном слое находится один электрон, который значительно удалён от ядра. Поэтому характерной особенностью атомов щелочных металлов является их склонность к отдаче электронов с образованием однозарядных катионов.
При переходе слева направо по периоду, вследствие увеличения заряда ядра и уменьшения радиуса атомов элементов, энергия ионизации в основном растёт и достигает максимумов у атомов благородных газов, обладающих энергетически устойчивой электронной конфигурацией n s 2n p 6 (рис. 10). После завершения периода величина энергии ионизации резко снижается у атомов щелочных металлов, начинающих новый период.
В пределах групп А (s - и р -элементы) энергия ионизации уменьшается сверху вниз (рис. 11). Это означает, что на взаимодействие внешнего электрона с атомным ядром больше влияет увеличение радиуса атома, чем заряда его ядра, эффективная величина которого понижена за счёт экранирования электронами внутренних слоёв.
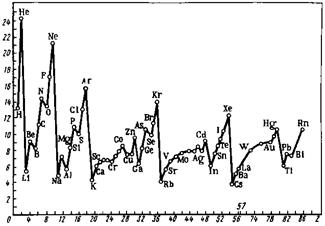
Рис. 10. Периодическая зависимость первой энергии ионизации
атомов элементов (эВ) от порядкового номера Z
В группах Б (за исключением III), изменение энергии ионизации носит обратный характер, увеличиваясь сверху вниз (рис. 11). Это связано с тем, что увеличение радиуса атома элементов в группах Б относительно невелико, и поэтому увеличение заряда атомного ядра оказывает на энергию ионизации определяющее (более сильное) влияние, и внешний электрон притягивается атомным ядром сильнее.
Энергия ионизации является мерой восстановительной способности атомов элементов. Чем она меньше, тем легче атомы отдают электроны, и тем сильнее они проявляют восстановительные свойства.
| Рис. 11. Изменение основных характеристик атомов элементов в периодах и группах периодической системы Д.И. Менделеева |
Сродство к электрону
В результате химических реакций атомы могут не только отдавать, но и принимать электроны.
Под сродством к электрону (Eср) понимается энергия, которая выделяется при присоединении одного моля электронов к одному молю электронейтральных атомов с образованием при этом отрицательно заряженных атомов (анионов):
Э + ē → Э– + Еср, кДж/моль или эВ.
Закономерности изменения величины сродства к электрону объясняются теми же причинами, что и изменение величины энергии ионизации.
Сродство к электрону с ростом порядкового номера элементов в пределах периода в целом растёт слева направо и достигает максимальных значений у атомов галогенов. Это связано с их электронной конфигурацией n s 2n p 5, в которой недостаёт одного электрона до полностью сформированной энергетически устойчивой конфигурации n s 2n p 6, характерной для атомов благородных газов, которые при обычных условиях химически инертны.
В больших периодах, которые состоят из чётных и нечётных рядов, изменение свойств атомов элементов происходит более плавно, чем в малых периодах, вследствие формирования (n – 1) d –подуровня при сохранении n s 2–подуровня.
В атомах элементов чётных рядов на внешнем энергетическом уровне находятся n s 2-электроны, поэтому их восстановительные свойства ослабевают с ростом заряда атомного ядра незначительно. В атомах элементов нечётных рядов формируются n p -подуровни, и с этим связано значительное ослабление их восстановительных свойств.
В группах А сверху вниз происходит уменьшение сродства к электрону атомов элементов вследствие увеличения их радиуса. В группах Б сверху вниз, наоборот, сродство к электрону атомов элементов увеличивается, что связано со значительным возрастанием заряда их ядер и незначительным увеличением радиуса за счёт d-сжатия (рис. 11).
Сродство к электрону является мерой окислительной способности атомов элемента. Чем оно выше, тем легче атомы присоединяют электроны, и тем сильнее они проявляют окислительные свойства.
Для ряда химических элементов – большинства металлов и благородных газов – сродство к электрону атомов близко к нулю или отрицательно. Это означает, что у них нет стабильного отрицательного иона, и они не способны присоединять электроны без затраты энергии извне.
Электроотрицательность
Если атомы двух химических элементов сильно различаются значениями энергии ионизации и сродства к электрону, то они способны легко взаимодействовать друг с другом с образованием прочной химической связи.
Однако использование указанных характеристик ограничено тем, что они относятся только к изолированным электронейтральным атомам. Если же атомы находятся в составе химического соединения, то для характеристики их способности притягивать к себе общие электроны введено понятие электроотрицательности (ЭО)*.
Электроотрицательность – величина, характеризующая способность атома в молекуле (или сложном ионе) притягивать электроны, участвующие в образовании ковалентной связи.
И хотя электроотрицательность, зависящая от валентного состояния атома и типа химического соединения, в котором он находится, имеет условный характер, её использование полезно для характеристики как отдельных ковалентных связей, так и химического соединения в целом.
Электроотрицательность атома равна полусумме его энергии ионизации и сродства к электрону:
ЭО = 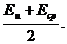
На практике обычно пользуются величиной относительной электроотрицательности, принимая за единицу величину электроотрицательности атома лития.
Относительная электроотрицательность атома какого–либо элемента, обозначаемая греческой буквой χ (хи), равна ЭОА/ЭОLi.
Наибольшую относительную электроотрицательность имеет атом фтора – 4,0, наименьшую – атомы цезия и франция – 0,7. Относительно этих величин рассматриваются электроотрицательности атомов остальных элементов (табл. 7). Наименьшие значения относительной электроотрицательности имеют электронейтральные атомы s-элементов I группы, а наибольшие – атомы p -элементов VI и VII групп. Чем больше относительная электроотрицательность, тем сильнее атом проявляет окислительные свойства и тем сильнее притягивает общую электронную пару ковалентных связей в химических соединениях.
У атомов элементов в пределах периода с увеличением заряда ядра происходит увеличение электроотрицательности (наименьшие значения имеют атомы щелочных металлов – элементов группы IA, наибольшие – атомы галогенов – элементов группы VIIA). Это обусловлено тем, что число электронных слоёв в атомах не изменяется, а заряд ядра по периоду растёт, и поэтому взаимодействие электронов с ядром усиливается, и, как следствие, уменьшается размер (радиус) атомов. В этом же направлении увеличиваются энергия ионизации, сродство к электрону и электроотрицательность атомов элементов. В соответствии с этим восстановительные свойства атомов элементов ослабевают в периоде слева направо, а окислительные свойства – усиливаются. Самые сильные окислители в периоде – атомы галогенов.
В группах А значения электроотрицательности атомов элементов, а следовательно, и окислительные свойства уменьшаются сверху вниз, а в группах Б (за исключением III), наоборот, увеличиваются.
Таким образом, самым сильным окислителем является атом фтора (группа VIIA), а самым сильным восстановителем – атом франция (группа IA) (рис. 12).
В большинстве случаев связи в молекулах имеют промежуточный характер между двумя предельными случаями – ковалентным или ионным типами связи. Например, в молекуле иодистого водорода HI связь не является ни чисто ковалентной, ни чисто ионной.
По разности значений относительных электроотрицательностей атомов элементов судят о степени ионности связей. При разности χ больше 2,0 связь может считаться ионной, при разности 0,4–2,0 возникает ковалентная связь с частично ионным характером, и при разности меньше 0,4 связь считается чисто ковалентной.
По величине относительной электроотрицательности атомов элементы условно делят на металлы и неметаллы, граница между которыми в Периодической системе Д.И. Менделеева (в её полудлинном, 18-клеточном варианте) проводится по элементам главных подгрупп по диагонали от бора до астата. Значения χ атомов граничных – амфотерных* – элементов близка к 2 (они выделены в табл. 2 жирным шрифтом).
| Таблица 7 Относительные электроотрицательности атомов, эВ | F 4,0 | Cl 3,0 | Br 2,8 | I 2,5 | At 2,2 | |
| O 3,5 | S 2,5 | Se 2,4 | Te 2,1 | Po 2,0 | ||
| N 3,0 | P 2,1 | As 2,0 | Sb 1,9 | Bi 1,9 | ||
| C 2,5 | Si 1,8 | Ge 1,8 | Sn 1,8 | Pb 1,9 | ||
| B 2,0 | Al 1,5 | Ga 1,6 | In 1,7 | Tl 1,8 | ||
| Zn 1,6 | Cd 1,7 | Hg 1,9 | ||||
| Cu 1,9 | Ag 1,9 | Au 2,4 | ||||
| Ni 1,9 | Pd 2,2 | Pt 2,2 | ||||
| Co 1,9 | Rh 2,2 | Ir 2,2 | ||||
| Fe 1,8 | Ru 2,2 | Os 2,2 | ||||
| Mn 1,5 | Te 1,9 | Re 1,9 | ||||
| Cr 1,6 | Mo 1,8 | W 1,7 | ||||
| V 1,6 | Nb 1,6 | Ta 1,5 | ||||
| Ti 1,5 | Zr 1,4 | Hf 1,3 | ||||
| Sc 1,3 | Y 1,2 | La-Lu 1,0-1,2 | ||||
| Be 1,5 | Mg 1,2 | Ca 1,0 | Sr 1,0 | Ba 0,9 | ||
| H 2,1 | Li 1,0 | Na 0,9 | K 0,8 | Rb 0,8 | Cs 0,7 |
Главные подгруппы
| I | II | III | IV | V | VI | VII | VIII | 
| |
| H | He | |||||||||
| Li | Be | B | C | N | O | F | Ne | |||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||
| K | Ca | Ga | Ge | As | Se | Br | Kr | |||
| Rb | Sr | In | Sn | Sb | Te | I | Xe | |||
| Cs | Ba | Tl | Pb | Bi | Po | At | Rn | |||
| Fr | Ra | |||||||||
|
| Неметалл | Металл | Амфотерный элемент |
Рис. 12. Изменение окислительно-восстановительных свойств
атомов элементов главных подгрупп (А-групп)
Слово ″кислота″ и ″основание″ – это функциональные определения, а не этикетки с названиями. Они скорее указывают на что способно вещество, чем что оно собой представляет.
Р. фон Хандлер (1931).
2.5. Кислотно-оснóвные и другие свойства химических соединений
Периодичность свойств элементов, связанная с изменением строения электронных оболочек их атомов при возрастании заряда атомного ядра, проявляется и в их однотипных соединениях.
Периодическая система химических элементов построена так, что слева внизу располагаются те элементы, гидроксиды которых проявляют свойства оснований. Особенно ярко проявляются эти свойства у щелочных металлов. Наоборот, в правой части таблицы расположены элементы, оксиды которых под действием воды превращаются в гидроксиды, обладающие кислотными свойствами, то есть кислоты. Оксидам и гидроксидам многих элементов – тех, что оказались в середине таблицы Менделеева, – присуща двойственность поведения. Взаимодействуя с сильными кислотами, они ведут себя как основания, а в реакциях со щелочами – как кислоты.
В периодах при переходе слева направо свойства оксидов и гидроксидов с оснόвных для элементов групп IA–IIА постепенно сменяются на амфотерные и в случае элементов групп VA–VIIA становятся кислотными.
Для оксидов и гидроксидов элементов, значения относительных электроотрицательностей атомов которых находятся в интервале 1,5–2,2, обычно характерны амфотерные свойства. При этом чем меньше значения χ, тем больше проявляются оснóвные свойства, и, наоборот, чем больше значения χ, тем больше проявляются кислотные свойства их оксидов и гидроксидов. Например, для атома элемента группы IIIА галлия (χ = 1,7) кислотные и оснóвные свойства Ga2O3 и Ga(OH)3 выражены в одинаковой степени.
Радиусы катионов меньше радиусов электронейтральных атомов, так как они образованы путём отдачи электронов, а радиусы анионов – больше, так как они образованы путём принятия электронов.
В молекулах гидроксидов Э–О–Н по группам сверху вниз увеличивается расстояние между атомами элемента и кислорода Э–О, а значит уменьшается сила их взаимодействия. В соответствии с этим увеличивается степень электролитической диссоциации по связи Э–О.
Э+ + ОН–  Э–О–Н
Э–О–Н  ЭО– + Н+
ЭО– + Н+
и усиливается оснóвный характер гидроксидов, а степень диссоциации по связи О–Н уменьшается, их кислотные свойства ослабевают (рис. 13).
Например:
Be(ОH)2 – амфотерное соединение, Mg(OH)2 – слабое основание, Ca(OH)2 – сильное основание;
метафосфорная кислота НРО3 значительно слабее, чем азотная кислота НNО3.
В то же время для бинарных* соединений неметаллов с водородом типа HF, HC1, HBr, HI или H2O, H2S, H2Se, H2Te кислотные свойства возрастают в группах А сверху вниз от HF к HI и от H2O к H2Te.
Главные подгруппы
| I | II | III | IV | V | VI | VII | VIII | 
| |
| H | He | |||||||||
| Li | Be | B | C | N | O | F | Ne | |||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||
| K | Ca | Ga | Ge | As | Se | Br | Kr | |||
| Rb | Sr | In | Sn | Sb | Te | I | Xe | |||
| Cs | Ba | Tl | Pb | Bi | Po | At | Rn | |||
| Fr | Ra | |||||||||
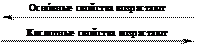
|
| Li | Оснóвной оксид | Be | Амфотерный оксид | B | Кислотный оксид |
Рис. 13. Изменение кислотно-основных свойств оксидов и гидроксидов элементов главных подгрупп (А-групп)