ДИАГРАММА СОСТОЯНИЯ
Правило фаз
Диаграмма состояния представляет собой графическое изображение состояния сплава. Если изменяется состав сплава, его температура, давление и состояние сплава также изменяется, то это находит графическое отображение в диаграмме состояния.
Диаграмма состояния показывает устойчивые состояния, т. е. состояния, которые при данных условиях обладают минимумом свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. В соответствии с этим и изменения в состоянии, которые отражены на диаграмме, относятся к равновесным условиям, т. е. при отсутствии перенагрева или переохлаждения. Однако, как мы видели раньше, равновесные превращения, т. е. превращения в отсутствие переохлаждения или перенагрева, в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай, а в практике используется для рассмотрения превращений при малых скоростях нагрева или охлаждения.
Общие закономерности сосуществования устойчивых фаз, отвечающих теоретическим условиям равновесия, могут быть выражены в математической форме, именуемой правилом фаз, или законом Гиббса.
Правило фаз дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов.
Фазой называется однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела при переходе через которую химический состав или структура вещества изменяется скачком.
Следовательно, однородная жидкость является однофазной системой, а механическая смесь двух видов кристаллов — двухфазной, так как каждый кристалл отличается от другого по составу или по строению и они отделены один от другого поверхностью раздела.
Компонентами называются вещества, образующие систему. Следовательно, чистый металл представляет собой однокомпонентную систему, сплав двух металлов — двухкомпонентную и т.д. Химические соединения можно рассматривать как компоненты лишь в том случае, если они не диссоциируют на составные части в исследуемых интервалах температур.
Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз в системе.
Если число степеней свободы равно нулю (нонвариантная система) то, очевидно, нельзя изменять внешние и внутренние факторы системы (температуру, давление, концентрацию) без того, чтобы это не вызвало изменения числа фаз.
Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных факторов и это не вызовет уменьшения или увеличения числа фаз.
Правило фаз представляет собой математическое выражение условия равновесия системы, т. е. уравнение правила фаз показывает количественную зависимость между числом степеней свободы системы с и числом компонентов k и фаз f:
C = k – f + 2
При выводе уравнения правила фаз исходили из того, что термодинамический потенциал каждого компонента во всех сосуществующих фазах минимален, поэтому система не стремится ни к каким изменениям и находится в равновесном состоянии. Правило фаз и все связанные с ним выводы справедливы только для равновесного состояния.
Независимыми переменными в уравнении правила фаз являются концентрация, температура и давление. Если принять, что все превращения в металле происходят при постоянном давлении, то число переменных уменьшится на единицу (давление постоянно), и уравнение правила фаз примет следующий вид:
с = k — f + 1.
Это выражение правила фаз будем применять к металлическим системам равновесия, считая давление во всех процессах неизменным.
Посмотрим, как изменяется степень свободы однокомпонентной системы (k = 1) для случая кристаллизации чистого металла. Когда металл находится в жидком состоянии, т. е. f = 1 (одна фаза — жидкость), число степеней свободы равно 1 (с = k — f + 1=1 – 1 + 1 = 1).
Температуру в данном случае можно изменять, не изменяя агрегатного состояния. В момент кристаллизации f = 2 (две фазы — твердая и жидкая),
с = k — f + 1=1 – 2 + 1 = 0. Это значит, что две фазы находятся в равновесии при строго определенной температуре (температуре плавления), и она не может быть изменена до тех пор, пока одна из фаз не пропадет, т. е. система не станет моновариантной (с = 1).
Экспериментальное построение диаграмм
Обычно для построения диаграмм состояния пользуются результатами термического анализа, т.е. строят кривые охлаждения и по остановкам и перегибам на этих кривых, вызванным тепловым эффектом превращений, определяют температуры превращения.
Температуру металлов измеряют обычно при помощи термопары.
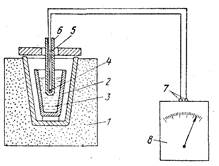
Температура кристаллизации определяется следующим образом. В печь 1 (рис. 1) помещают тигелек 2, в котором расплавляют исследуемый сплав 3. Затем в расплав погружают горячий спай 4 термопары 5 (защищенной фарфоровым или кварцевым колпачком 6) и выключают печь. Начинается охлаждение и температуру отмечают через определенные промежутки времени. Появление изменений в агрегатном состоянии в связи с выделением скрытой теплоты превращения отражается на кривой температура — время.
|
Имея достаточное количество сплавов и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния.
Для более точного построения диаграммы состояния в дополнение к термическому методу изучают с помощью микроскопа и рентгеновских лучей структуру сплавов разного состава и по-разному обработанных термически, измеряют разнообразнейшие физические свойства сплавов и т.д.
Вид диаграммы определяется характером взаимодействий, которые возникают между компонентами в жидком и твердом состояниях. Во всех случаях предполагают, что в жидком состоянии существует неограниченная растворимость, т. е. однородная фаза (в дальнейшем будет обозначаться буквой L) существует при любом соотношении компонентов.