Оба компонента неограниченно растворимы в жидком и твердом состояниях и не образуют химических соединений.
Компоненты: А, В.
Фазы: L, α.
Если два компонента неограниченно растворяются в жидком и твердом состояниях, то возможно существование только двух фаз — жидкого раствора L и твердого раствора а. Следовательно, трех фаз быть не может, кристаллизация при постоянной температуре не наблюдается и горизонтальной линии на диаграмме нет.
Диаграмма, изображенная на рис. 6, состоит из трех областей:
жидкость, жидкость + твердый раствор и твердый раствор.
Линия АтВ является линией ликвидус, а линия АпВ — линией солидус. Процесс кристаллизации изображается кривой охлаждения сплава (рис. 6).
Точка 1 соответствует началу кристаллизации, точка 2 — концу. Между точками 1 и 2 (т. е. между линиями ликвидус и солидус) сплав находится в двухфазном состоянии. При двух компонентах и двух фазах система моновариантна (с = k - f + 1 = 2 - 2 + 1 = 1), т. е. если изменяется температура, то изменяется и концентрация компонентов в фазах; каждой температуре соответствуют строго определенные составы фаз. Концентрация и количество фаз у сплава, лежащего между линиями солидус и ликвидус, определяются правилом отрезков. Так, сплав К в точке а состоит из жидкой и твердой фаз. Состав жидкой фазы определится проекцией точки b, лежащей на линии ликвидус, а состав твердой фазы — проекцией точки с, лежащей на линии солидус. Количество жидкой и твердой фаз определяется из следующих соотношений: количество жидкой фазы ас/bс, количество твердой фазы ba/bc.
Обратим внимание, что во всем интервале кристаллизации (от точки 1 до точки 2) из жидкого сплава, имеющего исходную концентрацию К, выделяются кристаллы, более богатые тугоплавким компонентом. Состав первых кристаллов определится проекцией s. Закончиться кристаллизация сплава К должна в точке 2, когда последняя капля жидкости, имеющая состав l, затвердеет. Отрезок, показывающий количество твердой фазы, равнялся нулю в точке 1, когда только началась кристаллизация, и количеству всего сплава в точке 2, когда кристаллизация закончилась. Состав жидкости изменяется по кривой 1 — l, а состав кристаллов — по кривой s — 2, и в момент окончания кристаллизации состав кристаллов такой же, как и состав исходной жидкости.
|
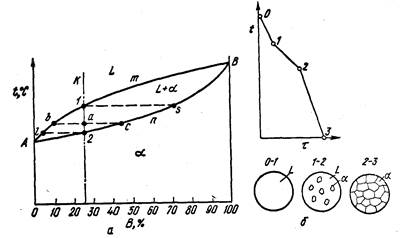
Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (III рода)
Оба компонента неограниченно растворимы в жидком состоянии, ограниченно в твердом и не образуют химических соединений.
Компоненты: А, В.
Фазы: L, α, β.
В сплавах такого рода возможно существование: жидкой фазы, твердого раствора компонента В в А, который мы будем называть α - раствором, и твердого раствора компонента А в В, который обозначим через β. В этих сплавах возможно нонвариантное равновесие при одновременном сосуществовании трех фаз: L, α, β. В зависимости от того, какая реакция протекает в условиях существования трех фаз, могут быть два вида диаграмм: диаграмма с эвтектикой и диаграмма с перитектикой.
Диаграмма с эвтектикой
В этой системе не образуются фазы, представляющие собой чистые компоненты. Из жидкости могут выделяться только твердые растворы α или β. Следовательно, около вертикалей А и В (рис. 7), соответствующих чистым компонентам, находятся области существования твердых растворов α или β. Предельная растворимость компонента В в А определяется линией DF, а предельная растворимость А в В— линией CG.
|
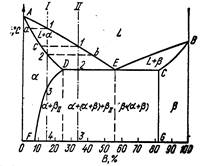
Сплавы, находящиеся между этими двумя линиями, находятся за пределами растворимости и являются двухфазными, состоящими из α + β. Окончание кристаллизации происходит по эвтектической реакции
L → α + β.
Линия АЕВ является на этой диаграмме линией ликвидус, линия ADCB — линией солидус. Зная правило фаз и правило отрезков, можно проследить за процессом кристаллизации любого сплава.
Кристаллизация сплава I. Выше точки 1 сплав находится в жидком состоянии. В точке 1 начинается процесс кристаллизации. Выделяются кристаллы твердого раствора α, концентрация которого изменяется по кривой а — 2, а состав жидкости изменяется по кривой 1 — b. В точке 2 кристаллизация закончится, и полученные кристаллы твердого раствора должны иметь (для равновесной кристаллизации) концентрацию исходной жидкости. Эти кристаллы не претерпевают изменений до точки 3, лежащей на линии предельной растворимости. Ниже этой точки твердый раствор α является пересыщенным и выделяет избыточные кристаллы. Такими кристаллами являются кристаллы β-твердого раствора, что определяют, применяя правило рычага для сплава, лежащего внутри двухфазной области α + β (т. е. для сплава ниже линии DF).
Состав твердого раствора а изменяется по кривой 3 — F, вследствие выделения кристаллов β концентрации G. Количество кристаллов β при охлаждении увеличивается. Количество кристаллов β, выделившихся из сплава I, характеризуется отрезком от вертикали I до линии 3 — F.
Кривая охлаждения и схемы структур этого сплава при различных температурах показаны на рис. 8.
|
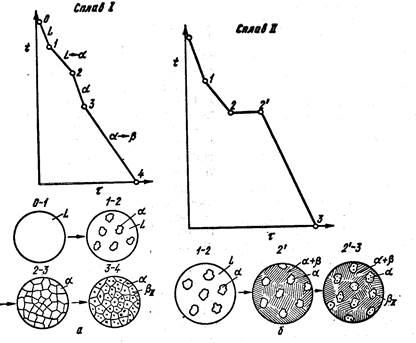
Процесс выделения вторичных кристаллов из твердой фазы носит
название вторичной кристаллизации в отличие от процесса первичной кристаллизации, когда кристаллы (первичные) образуются в жидкой
фазе.
Нужно отметить, что сплав, концентрация которого лежит левее точки F, не будет иметь вторичных выделений β-кристаллов.
Так как линия CG в отличие от линии FD изображена на рис. 7 вертикальной, т.е. растворимость компонента А в В не зависит от температуры, то вторичных выделений α-кристаллов нет, но они были бы, если бы линия CG была наклонена вправо, т. е. растворимость уменьшалась бы с понижением температуры.
Точка D для твердого раствора α показывает максимальную растворимость компонента В в компоненте А при наиболее благоприятных условиях.
Кристаллизация сплава II. При кристаллизации этого сплава, в отличие от предыдущего, при достижении горизонтальной линии DEC наступает нонвариантная реакция. В равновесии находятся три фазы — жидкость Е, α-кристаллы состава точки D и β-кристаллы состава точки С. Введем условную запись: индекс возле символа, обозначающего фазу, показывает состав фазы. Например, αD означает твердый раствор α состава точки D. По достижении температуры, соответствующей горизонтали DEC, наступает эвтектическая реакция — из жидкости выделяются кристаллы обоих твердых растворов:
LE → αD + βC.
|

Реакция эта нонвариантна, так как при двух компонентах в реакции участвуют три фазы (с = k – f + 1 = 2 — 3 + 1 = 0).
Все три фазы, участвующие в реакции, имеют определенные составы (проекции точек Е, D и С) и температура их превращения постоянна.
В результате кристаллизации сплава II, кроме первичных (выделившихся при охлаждении от точки 1 до точки 2) кристаллов α образуется еще эвтектика α + β.
При дальнейшем охлаждении вследствие изменения растворимости α -кристаллы выделяют вторичные кристаллы βII и при нормальной температуре α-кристаллы (как первичные, так и входящие в эвтектику) будут иметь состав, отвечающий точке F.
Кривая охлаждения сплава II и структуры этого сплава показана на рис. 8, б.
Выделение вторичных кристаллов из эвтектических составляющих обычно не обнаруживается при микроскопическом исследовании, так как вторичные выделения объединяются с такой же (одноименной) фазой эвтектики.
Несмотря на многообразие структурных составляющих, окончательно охлажденный сплав содержит только две фазы α и β, и правило фаз, если его применить ниже линии DE, покажет все количество α- и β-фаз независимо от того, в какой структурной форме они находятся.