Тема V. Образование связи углерод-кислород реакциями окисления
Окисление углеводородов
Бензойная кислота
Терефталевая кислота
Бензол-1,3,5-трикарбоновая (Тримезиновая) кислота
Бензол-1,2,4,5-тет-ракарбоновая (Пиромеллитовая) кислота
Окисление ароматического ядра
ЦИКЛОГЕКСА-2,5-ДИЕН-1,4-ДИОН (п -бензохинон)
АНТРАХИНОН
Окисление спиртов
БЕНЗИЛ (дибензоил)
АДИПИНОВАЯ КИСЛОТА
Окисления вторичных спиртов ДО кетонОВ (общая методика)
Циклогексанон
1‑фенилпропанон-1 (пропиофенон)
1‑фенилбутанон-1 (бутирофенон)
1‑фенилпента- нон-1 (валерофенон)
Бензофенон
Нонанон-5
Окисление углеводородов
Бензойная кислота

Метод 1
В круглодонную колбу объемом 250 мл помещают 3,0 мл толуола, 3,2 г тонко измельченного перманганата калия и 75 мл воды. Содержимое колбы нагревают на кипящей водяной (или песчаной) бане в течение 3‑4 ч при постоянном перемешивании до исчезновения окраски перманганата. Если раствор после трехчасового нагревания остается окрашенным в фиолетовый цвет, то добавляют несколько капель этанола, что обеспечивает восстановление остаточного количества перманганат‑анионов.
По окончании реакции реакционную смесь охлаждают, отфильтровывают выпавший оксид марганца(IV) на воронке Бюхнера, дважды промывают осадок на фильтре небольшим количеством горячей воды. Фильтрат упаривают до объема 15‑20 мл, снова отфильтровывают выпавший оксид марганца(IV) и промывают один раз 5 мл горячей воды. Фильтрат – раствор бензоата калия – доводят до кислой реакции среды (pH около 2) действием разбавленной (1:1) соляной кислоты. При этом в осадок выпадает бензойная кислота. Выпавшую бензойную кислоту отфильтровывают, промывают небольшим количеством холодной воды и сушат. Выход около 1 г.
Метод 2 Окисление с катализатором межфазного переноса
В трехгорлую круглодонную колбу, снабженную механической мешалкой, обратным холодильником и термометром, помещают 14 мл воды, 0,02 г триэтилбензиламмонийхлорида (ТЭБАХ), 0,3 г гидроксида натрия. Затем вносят 1,8 г толуола и 3,2 г перманганата калия и смесь нагревают на кипящей водяной бане при перемешивании. После достижения температуры 75‑80 °С температура повышается самопроизвольно до 90‑95 °С, и смесь закипает. Перемешивание продолжают до обесцвечивания раствора (примерно 2 часа). Если раствор после двухчасового нагревания остается окрашенным в фиолетовый цвет, то добавляют 0,2‑0,5 мл этанола, что обеспечивает восстановление остаточного количества перманганат‑анионов. Затем горячий раствор отфильтровывают от выпавшего диоксида марганца, осадок на фильтре промывают три раза по 10 мл горячей воды. При необходимости фильтрат обесцвечивают сульфитом натрия, затем упаривают до половины объема и подкисляют при охлаждении концентрированной соляной кислотой. Выпавший осадок отфильтровывают и высушивают на воздухе. Выход около 2,2 г.
Т. пл. 122 °С.
По данной методике могут быть получены:
| метиларен | мольные соотношения алкиларен: KMnО4: ТЭБАХ: Н2О | Т, °С | время, час | продукт реакции | выход, % (т. пл., °С) |
| п -ксилол | 1: 4: 6,8×10-3 : 70 | 1.5 | Терефталевая кислота | 95 (cубл. без плавл.) | |
| 1,3,5‑триметил-бензол (мезитилен) | 1: 3: 1,7×10-2 : 170 | бензол-1,3,5-трикарбоновая (Тримезиновая) кислота | (380) | ||
| 1,2,4,5‑тетра-метилбензол (дурол) | 1: 10: 6,9×10-2 : 180 | 4.5 | бензол-1,2,4,5-тет-ракарбоновая (Пиромеллитовая) кислота | (275) |
Вопросы для самоподготовки.
1. Составьте полное уравнение реакции окисления алкиларена в ходе проведенного Вами синтеза.
2. До каких продуктов окисляются при нагревании с перманганатом калия: а) этилбензол, б) изопропилбензол, в) трет -бутилбензол? Составьте полные уравнения реакций.
3. Какие еще окислители сходного действия Вам известны? Приведите примеры.
4. Рассмотрите механизм действия катализатора межфазного переноса в реакции окисления перманганатом. В каких еще реакциях можно использовать межфазный катализ четвертичными аммонийными солями? Приведите пример.
Окисление ароматического ядра
Вопросы для самоподготовки.
1. Составьте полные уравнения реакции окисления, протекающей в ходе осуществленного Вами синтеза. Предложите возможный механизм ее протекания.
2. Как будет вести себя по отношению к окислителю (хромовая смесь) п -крезол (п -метилфенол) или п -метиланилин?
3. Образование какого продукта возможно при неполном окислении гидрохинона? Напишите схему реакции.
4. Что такое хингидрон?
5. На чем основано использование гидрохинона в качестве антиоксиданта?
ЦИКЛОГЕКСА-2,5-ДИЕН-1,4-ДИОН
(п -бензохинон)
Метод 1
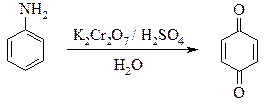
В полулитровой трехгорлой колбе, снабженной механической мешалкой и термометром, растворяют 9,3 г анилина[1] в смеси 250 мл воды и 50 мл концентрированной серной кислоты. Колбу помещают в воду со льдом, охлаждают раствор до 5 °С и при постоянном перемешивании вносят небольшими порциями тонко измельченный бихромат калия. Если для работы применяют бихромат натрия, то его прибавляют при помощи делительной воронки в виде 20 % водного раствора. Наблюдают, чтобы температура реакционной смеси не поднималась выше 10 °С. Если температура поднимается выше указанной, прекращают на короткое время прибавление бихромата и бросают в колбу несколько кусочков льда. После того как внесено 10 г бихромата калия, реакционную смесь оставляют стоять в течение ночи в холодном месте. На другой день, при охлаждении и перемешивании, вносят еще 18 г бихромата калия и оставляют на несколько часов.
Для выделения образовавшегося хинона раствор переносят в делительную воронку и экстрагируют его сначала 30 мл бензола (вместо бензола можно использовать диэтиловый эфир или дихлорметан), а затем еще три раза порциями по 15 мл растворителя. Объединенные бензольные вытяжки сушат небольшим количеством сульфата магния, фильтруют через маленький фильтр в перегонную колбу и отгоняют растворитель на водяной бане. Как только в холодильнике начнут появляться кристаллы хинона (в случае использования бензола в качестве растворителя), перегонку прекращают, содержимое колбы выливают в чистый стакан, откуда через некоторое время переносят на фильтровальную бумагу. Высушивают хинон сначала между листами фильтровальной бумаги, а затем в эксикаторе над хлоридом кальция. Выход около 5 г.
ЦИКЛОГЕКСА-2,5-ДИЕН-1,4-ДИОН
(п-бензохинон)
Метод 2

В трехгорлой колбе объемом 250 мл, снабженной механической мешалкой, термометром и капельной воронкой, готовят раствор 5 г гидрохинона в 100 мл воды, нагретой до 50 °С. Когда гидрохинон полностью растворится, раствор охлаждают до 20 °С и медленно прибавляют к нему 5 г концентрированной серной кислоты, после чего смесь вновь охлаждают до 20 °С. К полученному раствору гидрохинона медленно при перемешивании реакционной смеси прибавляют раствор 14 г бихромата натрия в 6,5 мл воды. Температура внутри колбы должна при этом быть не выше 30 °С. Сначала образуется почти черный осадок хингидрона, который по мере прибавления бихромата становится желтовато‑зеленым.
Как только цвет осадка перестанет изменяться, прекращают прибавление раствора бихромата (обычно на окисление расходуется 5‑6 мл раствора бихромата натрия). Смесь охлаждают до 10 °С, выпавший осадок отфильтровывают на воронке Бюхнера, промывают небольшим количеством воды. Фильтрат дважды экстрагируют бензолом, можно использовать диэтиловый эфир или дихлорметан (порциями по 10 мл). Полученный осадок вместе с фильтром помещают в круглодонную колбу, снабженную обратным холодильником, добавляют 15 мл растворителя (тот которым проводили экстракцию) и нагревают на теплой водяной бане, интенсивно встряхивая колбу. Слой растворителя аккуратно декантируют (тяга!), а в колбу прибавляют вторую порцию растворителя и операцию повторяют. Органические вытяжки, полученные при экстракции фильтрата и при промывании осадка, объединяют и сушат безводным хлоридом кальция. Растворитель отгоняют с дефлегматором, к остатку добавляют 30 мл холодной воды и охлаждают колбу в ледяной воде. Выпавшие желтые кристаллы отфильтровывают и сушат на воздухе. Выход – около 4 г.
Т. пл. 116 °С.
АНТРАХИНОН



Окисление спиртов
БЕНЗИЛ
(дибензоил)

Работу проводят в вытяжном шкафу!
В круглодонную колбу объемом 100 мл помещают 20 мл уксусной кислоты и к ней постепенно, при охлаждении водой добавляют 10 мл концентрированной азотной кислоты (r = 1,4). К приготовленной смеси добавляют 4,5 г 2-гидрокси-1,2-дифенилэтанона (бензоина), присоединяют к колбе обратный холодильник и кипятят в течение 2 часов на водяной бане. В процессе окисления происходит выделение окислов азота. Реакционной смесь охлаждают до комнатной температуры, а затем выливают при перемешивании в стакан с 75 мл воды и помещают его в ледяную баню. Выпавшие бледно-желтые кристаллы бензила отфильтровывают на воронке Бюхнера и перекристаллизовывают из спирта. Выход около 4,2 г. Т. пл. 92 °С.
АДИПИНОВАЯ КИСЛОТА

Работу проводят в вытяжном шкафу!
В трехгорлую колбу объемом 50 мл, снабженную обратным холодильником и капельной воронкой, помещают 14 г концентрированной азотной кислоты (r = 1,4). Азотную кислоту нагревают до кипения и при постоянном кипении прибавляют по каплям 2,5 г циклогексанола[2] со скоростью 8‑10 капель в минуту. Азотная кислота должна быть нагрета до кипения для того, чтобы окисление началось с момента попадания первых капель циклогексанола в кислоту. Если до начала кипения было уже добавлено некоторое количества циклогексанола, то может произойти сильный взрыв!
В начале реакция протекает очень бурно, поэтому циклогексанол следует прибавлять очень осторожно. После прибавления всего циклогексанола реакционную смесь кипятят еще 10‑15 минут, выливают в стакан, охлаждают льдом и отфильтровывают выпавшую адипиновую кислоту, хорошо отжимая ее на фильтре. Кислоту сушат на воздухе. Сырую адипиновую кислоту перекристаллизовывают из концентрированной азотной кислоты (r = 1,4). Выход около 1 г. Т. пл. 153 °С.
окисления вторичных спиртов ДО кетонОВ (общая методика)

В трехгорлую колбу объемом 250 мл, снабженную механической мешалкой, капельной воронкой, термометром и обратным холодильником (использовать двурогий форштос), наливают раствор 0,1 моль соответствующего спирта в 50 мл эфира. При перемешивании прибавляют в течение 15 мин раствор 0,0335 моль бихромата натрия (при расчете не забывать о кристаллизационной воде!) и 7,5 мл серной кислоты в 50 мл воды. Температура реакционной смеси 25 °С. Перемешивают еще 2 часа при той же температуре, эфирный слой отделяют, водный дважды экстрагируют порциями по 25 мл эфира. Объединенные эфирные вытяжки промывают насыщенным раствором бикарбоната натрия, водой, сушат сульфатом натрия или магния. После отгонки эфира остаток фракционируют на короткой колонке Вигре.
Методика пригодна для полумикросинтезов: в этом случае удобно применять магнитную мешалку.
По данной методике могут быть получены:
| исходный спирт | продукт реакции | выход, % | т. кип., °С (мм рт. ст.) | nD 20 |
| циклогексанол[3] | Циклогексанон | 155 (760) | 1,4503 | |
| 1-фенилпропанол-1[4] | 1‑фенилпропанон-1 (пропиофенон) | 93 (11)а) | 1,5270 | |
| 1-фенилбутанол-1 | 1‑фенилбутанон-1 (бутирофенон) | 110 (10) | 1,5204 | |
| 1-фенилпентанол-1[5] | 1‑фенилпента- нон-1 (валерофенон) | 140-142 (25) | 1,5078 | |
| дифенилметанол (бензгидрол)[6] | Бензофенон | 297 (760)а) | - | |
| нонанол-5[7] | Нонанон-5 | 75-76 (20) | 1,4189 | |
| Примечания: а) Т. пл. 21°С; б) При перегонке продукт закристаллизовывается в лабильную форму с Т. пл. 26°С, которая при стоянии переходит в стабильную с Т. пл. 48° С |
Вопросы для самоподготовки.
1. Составьте полные уравнения реакции окисления, протекающей в ходе проведенного Вами синтеза.
2. Предложите механизм осуществленной Вами реакции.
3. Какие окислители используются для окисления первичных спиртов до альдегидов или карбоновых кислот?
4. Какие окислители используются для окисления вторичных спиртов до кетонов?
5. В каких условиях образующийся при окислении спирта кетон способен к дальнейшему окислению? Как оно протекает?
[1] Получение анилина см. в теме VII
[2] Получение циклогексанола см. в теме VI
[3] Получение циклогексанола см. в теме VI
[4] Получение 1-фенилпропанола-1 см. в теме VI
[5] Получение 1-фенилпентанола-1 см. в теме VI
[6] Получение бензгидрола см. в теме VI
[7] Получение нонанола-5 см. в теме VI