ПЛАН-КОНСПЕКТ (ТЕЗИСЫЛЕКЦИИ)
проведения занятия по дисциплине «Химия радиоматериалов»
Полупроводниковые материалы. Классификация
и электрические свойства
(полное название темы в соответствии с тематическим планом)
Воронеж – 2011
ТЕМЫБЛОКА
| Вступительная часть ……………………………… 1. Классификация полупроводников. Основные свойства 2. Электрические свойства полупроводников 3.Полупроводниковые соединения типа AIII BV 4.Полупроводниковые соединения типа AIIBVI Типовые материалы, применяемые в качестве п/проводников |
Тема №4
Классификация полупроводниковых материалов
Полупроводниковый материал — материал, предназначенный для использования его полупроводниковых свойств.
Полупроводниковые материалы могут быть разделены на три группы:
• простые полупроводники — химические элементы, которыми являются В—бор, Si— кремний, Ge — германий, Р — фосфор, As — мышьяк, S — сера, Sb — сурьма, Те — теллур, I — йод, Se — селен;
• полупроводниковые химические соединения типа: a IVbIV - SiC и др, A IIIBV – InSb, GaAs и др., АIIBVI – CdS, ZnSe и др.; оксиды — Cu2O, TiO2 и др.;
• многофазные полупроводниковые материалы с полупроводящей или проводящей фазой из карбида кремния, графита и т.д.
Полупроводники представляют собой весьма многочисленный класс материалов. В него входят сотни самых разнообразных веществ: как элементов, так и химических соединений. Полупроводниковыми свойствами могут обладать как неорганические, так и органические вещества, кристаллические и аморфные, твердые и жидкие, немагнитные и магнитные. Несмотря на существенные различия в строении и химическом составе материалы этого класса роднит одно замечательное качество — способность сильно изменять свои электрические свойства под влиянием небольших внешних энергетических воздействий.
Одна из возможных схем классификации полупроводниковых материалов приведена на рис.. 1.
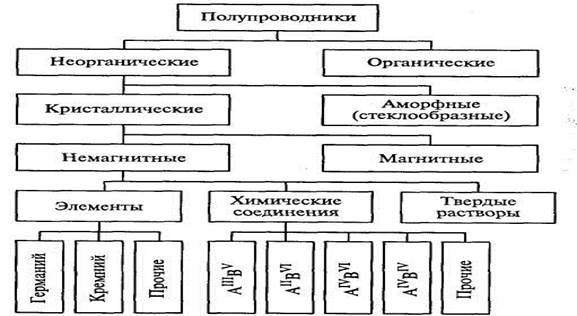
1. Классификация полупроводниковых материалов по составу и свойствам
Основу современной электроники составляют неорганические кристаллические полупроводники. Полупроводниковые свойства проявляют 12 химических элементов, находящихся в средней части Периодической системы элементов Д. И. Менделеева. Значения ширины запрещенной зоны элементарных полупроводников указаны в табл.1. Расположив элементы в порядке их следования в Периодической системе элементов Д. И. Менделеева, можно выявить некоторые закономерности в изменении ширины запрещенной зоны: она возрастает при переходе от элемента к элементу слева направо, но уменьшается в каждой группе при движении сверху вниз. Значения ДЭ хорошо коррелируют с температурой плавления материалов, поскольку обе эти величины определяются энергией связи атомов в кристаллической решетке.
Из табл.1 видно, что полупроводниковыми свойствами обладают и некоторые модификации олова и углерода. Последний существует в двух аллотропных формах: алмаз и графит. Графит по электрическим свойствам близок к проводникам (ДЭ < 0,1 эВ), а чистые алмазы являются диэлектриками. Однако искусственные алмазы под влиянием вводимых примесей приобретают свойства полупроводников.
Олово в нормальных условиях является хорошим проводником (белое олово, или β-модификация), но при температуре ниже 13,2 °С оно переходит в полупроводниковую α-модификацию (серое олово), обладающую структурой алмаза.
Среди всех элементарных веществ достойное место в полупроводниковой технике занимают лишь кремний и германий.
Полупроводниковые неорганические соединения могут состоять из двух, трех и большего числа элементов. В качестве примера таких соединений можно привести InSb, Bi2Te3, ZnSiAs2, CuGe2P3. Кристаллическая структура многих соединений характеризуется тетраэдрической координацией атомов, как это имеет место в решетке алмаза. Такие полупроводниковые соединения получили название алмазоподобных полупроводников. Среди них наибольший научный и практический интерес представляют бинарные соединения типа A!IIBV, A1^^ и А^В14', которые в настоящее время являются важнейшими материалами полупроводниковой опто-электроники.
Большинство алмазоподобных полупроводников с родственными свойствами образуют между собой изовалентные твердые растворы. В твердых растворах путем изменения состава можно плавно и в достаточно широких пределах управлять важнейшими свойствами полупроводников, в частности шириной запрещенной зоны и подвижностью носителей заряда. Это открывает дополнительные возможности для оптимизации параметров полупроводниковых приборов, позволяет добиться лучшего согласования физических характеристик различных компонентов электронной аппаратуры.
Для изготовления полупроводниковых приборов используются как монокристаллические, так и поликристаллические материалы. Монокристаллические представляют собой более простые системы, с более совершенным строением, чем поликристаллические материалы. Они наиболее глубоко изучены, физические явления в них лучше поддаются математическому моделированию, и они обеспечивают большую надежность и идентичность параметров полупроводниковых приборов.
Свойства аморфных, органических и магнитных полупроводников изучены пока недостаточно, хотя практическая значимость этих веществ непрерывно возрастает. Аморфные полупроводники относятся к классу неупорядоченных систем. По способу получения их принято подразделять на две группы.
Первую группу составляют аморфные полупроводники с ковалентными связями, причем это могут быть как элементарные вещества (аморфные кремний, германий, теллур, селен и др.), так и простейшие бинарные композиции (например, SiC, GaAs, CdS и т.п.). Как правило, их получают путем неравновесной конденсации из газовой фазы. Безусловным лидером среди этой группы материалов является гидрогенизированный аморфный кремний, интерес к которому обусловлен прежде всего возможностями создания на его основе самых дешевых фотоэлектрических преобразователей солнечной энергии (солнечных батарей).
Вторую группу представляют стеклообразные полупроводники, получаемые переохлаждением расплава. Их подразделяют нахалькогенидные и оксидные материалы. Халькогенидные стекла синтезируют сплавлением халькогенов с элементами III, IV и V групп Периодической системы элементов Д. И. Менделеева (например, As40S60, GeS2, Tl2Se и др.). Оксидные полупроводниковые стекла имеют сложный многоэлементный состав, который можно выразить обобщенной формулой вида V2O5—Р2О5—МеО^., где Me — металл I...IV групп Периодической системы элементов Д. И. Менделеева.
Полупроводниковые стекла обладают рядом интересных свойств, определяющих их практическое применение. В частности, они могут переходить из высокоомного состояния в низкоомное под влиянием электрического поля (эффект электрического переключения), что позволяет использовать их в качестве пороговых переключателей и элементов памяти. Халькогенидные стекла обладают хорошей прозрачностью для ИК-излучения, обладают внутренним фотоэффектом. Поэтому их применяют как фоточувствительную среду для оптической записи информации и как материал для световодов и мишеней видиконов (телевизионный передающий электронно-лучевой прибор). Оксидные стеклообразные полупроводники используются при создании датчиков температуры и давления.
В механизме электропроводности аморфных неорганических и кристаллических органических полупроводников выявлен ряд общих закономерностей. Интерес к органическим полупроводникам отчасти вызван тем, что в некоторых из них полупроводниковые свойства сочетаются с эластичностью, которая позволяет изготовлять рабочие элементы в виде гибких лент и волокон. В противоположность аморфным полупроводникам многие органические полупроводники имеют слоистую структуру. Наиболее исследованными органическими полупроводниками являются ароматические углеводороды, такие как нафталин, антрацен, тетрацен и др. Они представляют собой производные бензола и могут быть получены в виде монокристаллов, которые отличаются низкой симметрией.
Из элементов V группы при определенных условиях п/п свойства проявляют P, As, Sb. Однако п/п модификации этих элементов малодоступны, но они являются важнейшими п/п образующими (GaAs, AlP, InSb). Из элементов VI группа – Se, Te. Se является важнейшим п/п материалом, п/п образующим элементом, на основе которого получают селениды металлов. Te самостоятельного применения не имеет, но теллуриды широко применяются в качестве п/п материалов. S(сера) – изолятор, хотя она обладает сильно выраженной фотопроводимостью. S является основой сульфидов (Ag, Cd, Pb). В группе S-Se-Te с увеличением порядкового номера ΔЕ уменьшается. III В – единственный элементарный п/п, который не применяется: высокая температура плавления, значительная ΔЕ = 1.58 эВ, распространенность в природе (в 10 раз > Ge); недостаток – трудность получения в высокой степени чистоты монокристаллов.
Кремний
Общие сведения. По совокупности электрофизических свойств, отработанности технологических процессов, числу и номенклатуре выпускаемых приборов кремний занимает доминирующее положение среди всех полупроводниковых материалов. Среди главных факторов, определяющих исключительное место кремния в электронной технике, следует выделить следующие:
• широкая распространенность кремния в природе, доступность и дешевизна исходного сырья;
• высокая химическая стабильность;
• достаточно широкая запрещенная зона и высокая температура плавления;
• высокая технологичность материала, возможность его получения как в виде крупных монокристаллов, так и в виде тонких эпитаксиальных слоев совершенной структуры и высокой чистоты;
• легкость инверсии типа электропроводности;
• высокая растворимость легирующих примесей как донорного, так и акцепторного типов;
. отсутствие токсичности самого кремния и большинства химических соединений с ним;
. сравнительно высокая подвижность носителей заряда;
• относительно высокая теплопроводность, превышающая теплопроводность многих металлов;
• наличие стабильного, плотного собственного оксида, обладающего пассививирующими, маскирующими и защитными свойствами.
В свободном состоянии кремний в природе не встречается. В элементарном виде он впервые был получен известным шведским химиком Й.Я.Берцелиусом еще в 1824 г., однако как материал полупроводниковой электроники оказался востребованным лишь во второй половине XX в. после разработки эффективных методов его очистки.
Содержание кремния в земной коре составляет 29,5 % (по массе). По распространенности в природе он занимает среди элементов второе место после кислорода. Многочисленные соединения кремния входят в большинство горных пород и минералов. Песок и глина, образующие минеральную часть почвы, также представляют собой соединения кремния. Наиболее распространенным соединением этого элемента является диоксид SiO2 (кремнезем). Свободный диоксид кремния встречается в основном в виде минерала кварца. В ряде месторождений чистота кварцевого песка достигает 99,9 %. Именно такой песок и служит исходным сырьем при получении полупроводникового кремния.
Физико-химические и электрические свойства. Кремний кристаллизуется в структуре алмаза, элементарная ячейка которой содержит восемь атомов. Кристаллическую решетку типа решетки алмаза можно рассматривать как наложение двух кубических гранецентрированных решеток, сдвинутых друг относительно друга в направлении большой диагонали куба на четверть ее длины. Каждый атом находится в тетраэдрическом окружении четырех ближайших соседей, с которыми взаимодействует sр3-гибридными связями.
Для изготовления полупроводниковых приборов, элементов и структур применяется материал с определенными добавками электрически активных примесей. В качестве доноров и акцепторов обычно используются соответственно элементы V и III групп Периодической системы элементов Д.И.Менделеева. Эти примеси отличаются способностью образовывать прочные ковалентные связи с основными атомами кристаллической решетки кремния. Им соответствуют мелкие уровни в запрещенной зоне с энергией ионизации, близкой к 0,05 эВ. Поэтому в нормальных условиях концентрация носителей заряда в некомпенсированном полупроводнике равна концентрации примеси. Более сложным поведением отличаются примеси элементов I, II, VI, VII групп и VIIIА подгруппы Периодической системы элементов Д.И.Менделеева. При вхождении в кристаллическую решетку кремния атомы многих из этих элементов проявляют свойства многозарядовых центров, т.е. могут отдавать или принимать на себя более одного электрона. Возможность появления таких состояний обусловлена значительными различиями в валентностях атомов примесей и основы. Как правило, в этих случаях примесным состояниям отвечает несколько глубоких энергетических уровней в запрещенной зоне полупроводника. Например, примесные атомы меди создают в кремнии три акцепторных уровня с энергиями ионизации 0,24, 0,40 и 0,53 эВ, а при вхождении атомов железа образуется три донорных уровня с глубиной залегания относительно «дна» зоны проводимости 0,14, 0,51 и 0,72 эВ.
Примеси, создающие глубокие уровни, относительно слабо влияют на электропроводность материала, однако они сильно ограничивают время жизни неравновесных носителей заряда, а следовательно, могут играть важную роль в процессах рекомбинации и фотопроводимости.
Если концентрация примесных атомов превышает 1022 м-3, то рассеяние на ионизированных примесях начинает играть существенную роль даже при комнатной температуре. При одинаковой степени легирования подвижность дырок в материале р-типа всегда меньше подвижности электронов в кристаллах п-типа. Поэтому зависимость удельного сопротивления от концентрации легирующих примесей для полупроводников р-типа проходит выше, чем аналогичная зависимость для кристаллов и-типа.
Низкая подвижность носителей заряда при сильном легировании и ограниченная растворимость примесей затрудняют получение монокристаллов кремния с удельным сопротивлением менее 10 -5 Ом • м. При содержании примесных атомов более 1025 м -3 в полупроводнике возможно образование различных комплексов и микровыделений второй фазы, что сопровождается изменением электрической активности примесей. Это выражается в несоответствии концентрации носителей заряда содержанию введенных доноров или акцепторов.
В планарной технологии кремниевых приборов одним из основных методов легирования полупроводниковых пластин и создания р — n -переходов с заданной геометрией является диффузия электрически активных примесей. Для управления профилем распределения примеси по глубине пластины надо знать коэффициент диффузии D легирующего элемента, который и определяет скорость массопереноса. Численное значение коэффициентов диффузии в твердой фазе сильно зависит от температуры.
Существует определенная взаимосвязь между коэффициентами диффузии примесей и их растворимостью в твердой фазе: чем больше растворимость (чем шире область существования твердого раствора полупроводник—примесь), тем меньше коэффициент диффузии. Физическая сущность такой корреляции вытекает из кинетики теплового движения дефектов в кристаллах. Чем менее устойчиво состояние, тем выше скорость диффузии. В случае высокой растворимости примесные атомы проникают в кристаллическую решетку в основном по вакансиям. Если же атомы растворяемого элемента не могут замещать узлы решетки или не могут удержаться там вследствие слабой химической связи, то диффузия проходит по междоузлиям. Этот механизм характеризуется большой скоростью миграции атомов. В то же время в междоузельном пространстве может разместиться небольшое число атомов, что обусловливает малую растворимость.
Поскольку полезные примеси III и V групп Периодической системы элементов Д.И.Менделеева, специально вводимые в полупроводник для придания ему необходимых электрических свойств, диффундируют очень медленно, а некоторые нежелательные примеси (особенно медь, железо, щелочные металлы) диффундируют быстро, то при термообработке требуется тщательная защита поверхности полупроводниковых структур от возможных источников загрязнения.
Вследствие низких коэффициентов диффузии основных легирующих примесей диффузионное легирование кремния обычно проводят при достаточно высоких температурах (1100... 1350 °С) в течение длительного времени. При диффузионном легировании возникают трудности в получении тонких легированных слоев (доли микрометра) и резких p-n-переходов. Следует отметить, что в кремнии все мелкие доноры, за исключением фосфора, диффундируют значительно медленнее мелких акцепторов.
Плавление кремния сопровождается некоторым увеличением его плотности (примерно на 10 %) и скачкообразным уменьшением удельного сопротивления (примерно в 30 раз). В расплавленном состоянии кремний имеет удельное сопротивление порядка 10 -4 Ом • м и ведет себя подобно жидким металлам, т. е. характеризуется малой подвижностью и высокой концентрацией носителей заряда. Благодаря малому сопротивлению расплава облегчается индукционный разогрев материала при проведении процесса зонной плавки.
Обладая достаточно высокой температурой плавления (1414 °С), кремний химически очень активен в расплавленном состоянии. Поэтому возникают трудности с подбором тигельного материала при выращивании монокристаллов. Наиболее распространенные термостойкие материалы — кварц и графит, из которых обычно изготовляют лодочки и тигли, при высоких температурах взаимодействуют с кремнием. В результате реакции кремния с углеродом образуется карбид кремния SiC — очень устойчивое химическое соединение с полупроводниковыми свойствами.
В нормальных условиях, т. е. при комнатной температуре, кристаллический кремний в химическом отношении является достаточно инертным веществом. Он не растворим в воде, не реагирует со многими кислотами в любой концентрации. Хорошо растворяется лишь в смеси азотной и плавиковой кислот и в кипящих щелочах.
Кремний устойчив на воздухе при нагревании до 900 °С. Выше этой температуры он начинает интенсивно окисляться с образованием диоксида SiO2. При нагревании кремний легко взаимодействует с галогенами, а при температурах 1100...1300°С способен непосредственно соединяться с азотом с образованием нитрида Si3N4. Кремний хорошо растворим во многих расплавленных металлах (Al, Ga, Sn, Аи, Ag и др.). С рядом металлов (Сг, Mo, Fe, Си, Mg и др.) он образует устойчивые химические соединения — силициды.
Получение кремния. Исходным сырьем при получении кремния является природный диоксид SiO2 (кремнезем), из которого кремний восстанавливают углеродосодержащим материалом в электрических печах при температуре около 2 000 °С:

Технический кремний представляет собой мелкокристаллический спек, содержащий около 1 % примесей.
Технология получения кремния полупроводниковой чистоты включает в себя следующие операции:
1) превращение технического кремния в легколетучее соединение, которое после очистки может быть легко восстановлено;
2) очистка соединения физическими и химическими методами;
3) восстановление соединения с выделением чистого кремния;
4) окончательная кристаллизационная очистка и выращивание монокристаллов.
В полупроводниковом производстве наибольшее распространение получил метод водородного восстановления трихлорсилана SiHCl3. Последний получают обработкой измельченного технического кремния сухим хлористым водородом при температуре 300... 400 °С:
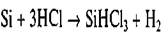
Трихлорсилан представляет собой жидкость с температурой кипения 32 "С.
Поэтому он легко очищается методами экстракции, адсорбции и ректификации.
Германий
Существование и основные свойства германия предсказал в 1870 г. Д. И. Менделеев, назвав его экасилицием.
Лишь спустя 16 лет, в 1886 г. немецкий химик К. Винклер обнаружил в минеральном сырье новый элемент, который назвал германием. Германий оказался тождественным экасилицию.
Германий относится к числу сильно рассеянных элементов, т.е. часто встречается в природе, но присутствует в различных минералах в очень небольших количествах. Его содержание в земной коре составляет около 7 • 10 -4 %, что примерно равно природным запасам таких распространенных металлов, как олово и свинец, и существенно превышает количество серебра, кадмия, ртути, сурьмы и ряда других элементов. Тем не менее, получение германия в элементарном виде вызывает большие затруднения. Минералы с большой концентрацией германия встречаются очень редко и не могут служить сырьем для производства этого полупроводника.
Подобно кремнию германий кристаллизуется в структуре алмаза, однако больший размер его атомов по сравнению с атомами кремния обусловливает увеличение межатомных расстояний и связанное с этим ослабление sр3-гибридных ковалентных связей. Отражением такой цепочки закономерностей являются невысокая температура плавления германия (936 °С) и относительно узкая запрещенная зона. В нормальных условиях ее значение составляет 0,665 эВ.
По сравнению с кремнием германий характеризуется более высокой растворимостью мелких акцепторов и меньшей растворимостью доноров, наиболее часто для легирования применяют галлий, сурьму и мышьяк, которые обладают высокой предельной растворимостью.
Примеси металлов I, II и переходной групп Периодической системы элементов Д. И. Менделеева создают в германии глубокие уровни и, как правило, играют вредную роль, сильно ограничивая диффузионную длину и время жизни носителей заряда.
На рисунке хорошо видны области температур, в которых проявляются собственная и
Как и в кремнии, рассеяние носителей заряда на ионизированных примесях играет существенную роль при комнатной температуре, если содержание легирующей примеси превосходит 1022 м~3. Уменьшение подвижности носителей заряда при возрастании степени легирования кристаллов является причиной нелинейной зависимости удельной проводимости от концентрации легирующих примесей (линейная зависимость отмечена на рис. 5.4 пунктирной линией а).
При плавлении германия происходит резкое изменение его электрических свойств. В расплавленном состоянии германий имеет удельное сопротивление (ρ=6,5- 10 -7 Ом-м), близкое к удельному сопротивлению ртути. Эта особенность играет очень важную роль при индукционном разогреве расплавленной зоны в случае проведения кристаллизационной очистки германия.
Кристаллический германий химически устойчив на воздухе при комнатной температуре. При нагревании на воздухе до температур выше 650 °С германий окисляется с образованием диоксида GeO2. В большинстве случаев образующийся диоксид германия представляет собой смесь кристаллической гексагональной и аморфной модификаций, которые обладают заметной растворимостью в воде. Из-за нестабильности свойств собственный оксид на поверхности германия, в отличие от собственного оксида кремния, не может служить надежной защитой материала при проведении процессов планарной технологии (фотолитографии и локальной диффузии).
При комнатной температуре германий не растворяется в воде, соляной и разбавленной серной кислотах. Активными растворителями германия в нормальных условиях являются смесь азотной и плавиковой кислот, раствор пероксида водорода и травители, содержащие в своем составе окисляющие реагенты. При нагревании германий интенсивно взаимодействует с галогенами, серой и сернистыми соединениями.
Даже в расплавленном состоянии вблизи температуры плавления германий обладает ничтожно малым давлением насыщенного пара. Отмеченное обстоятельство в сочетании с невысокой температурой плавления существенно упрощает технику кристаллизационной очистки и выращивания монокристаллов. Жидкий германий практически не взаимодействует с графитом и кварцевым стеклом, что позволяет использовать их в качестве тиглей и лодочек при проведении металлургических процессов.
Получение германия. Основными источниками германия при его промышленном получении являются побочные продукты цинкового производства, коксования углей, а также германиевые концентраты, получаемые из медно-свинцово-цинковых руд. В результате химической переработки исходного сырья образуется тетрахлорид германия GeCl4, который представляет собой жидкость с невысокой (83 °С) температурой кипения. Жидкость подвергают глубокой очистке, используя методы экстракции и ректификации, после чего очищенный тетрахлорид путем гидролиза переводят в диоксид согласно реакции
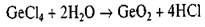
Элементарный германий получают восстановлением диоксида чистым водородом:
Процесс водородного восстановления проводят в электрических печах при температуре 650... 700 °С с использованием графита в качестве тигельного материала. Заключительная стадия восстановительного процесса совмещается с плавлением образующегося порошка германия и направленной кристаллизацией расплава. Изготовленные таким способом поликристаллические слитки в дальнейшем подвергают зонной плавке для получения германия особой чистоты или используют в качестве исходного материала при выращивании легированных монокристаллов методом вытягивания из расплава.
Карбид кремния
Карбид кремния SiC является единственным бинарным соединением, образуемым полупроводниковыми элементами IV группы Периодической таблицы элементов Д. И. Менделеева. В природе этот материал встречается крайне редко и в очень ограниченных количествах.
По типу химической связи карбид кремния относится к ковалентным кристаллам. Доля ионной связи, обусловленная некоторым различием в электроотрицательностях атомов Si и С, не превышает 10... 12 %. Энергия ковалентной связи между атомами кремния и углерода в кристаллах SiC почти в три раза превышает энергию связи между атомами в кристаллах кремния. Благодаря сильным химическим связям карбид кремния выделяется среди других материалов высокой химической и радиационной стойкостью, температурной стабильностью физических свойств, большой механической прочностью и высокой твердостью.
Технический карбид кремния изготовляют в электрических печах при восстановлении диоксида кремния (кварцевого песка) углеродом:
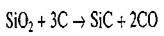
До температуры 2000 "С образуется кубическая β-модификация SiC, а при более высокой температуре восстановления — гексагональная α-модификация примерно с теми же межатомными расстояниями в кристаллической решетке. При температуре свыше 2600..2700 °С наблюдается возгонка карбида кремния.
В печи образуются сросшиеся пакеты кристаллов SiC, называемые друзами. Большинство кристаллов в друзах имеет незначительные размеры, однако встречаются кристаллы, имеющие площадь до 1,5...2 см2. Из друз путем дробления получают порошок карбида кремния. Монокристаллы полупроводниковой чистоты получают методом сублимации в электрических печах с графитовой арматурой. Классические методы вытягивания из расплава для карбида кремния неприменимы из-за слишком высокой температуры плавления (по расчетным оценкам Тпл - 4320 К) и очень высоких требуемых давлениях собственных компонентов.
Кристаллизация из газовой фазы может быть реализована как в условиях спонтанного образования зародышей (массовая кристаллизация), так и путем конденсации пара на ориентированной монокристаллической затравке (управляемая кристаллизация). В первом случае получают большое количество дендритных пластинчатых кристаллов небольшого размера с неоднородным легированием. Второй метод позволяет получать достаточно крупные объемные монокристаллы, пригодные для использования в качестве высококачественных подложек при создании различных полупроводниковых приборов на основе карбида кремния. Естественно, предпочтение отдается направленной кристаллизации, хотя она и оказывается более трудоемкой.
В качестве исходного сырья применяют порошкообразный карбид кремния, предварительно синтезированный из кремния и углерода особой чистоты. Выращивание кристаллов проводят либо в вакууме, либо в инертной среде (аргон, гелий), иногда с добавками водорода, при температуре 2 000... 2 600 "С. Тигель нагревают в цилиндрических печах с помощью резистивного графитового нагревателя или токами высокой частоты. Вдоль оси рабочего объема создают небольшой градиент температуры. Давлением инертного газа регулируют скорость массопереноса через газовую фазу, а соответственно, и скорость роста, которая может достигать 10 мм/ч. Массоперенос осуществляется потоками собственных компонентов, образующихся при разложении вещества-источника (Si, Si2C, SiC2 и др.). Освоено коммерческое производство кристаллов в диаметре до 75 мм и 20...25 мм в длину.
Степень легирования кристаллов регулируют изменением содержания примесей в исходной шихте или в газовой фазе. Наиболее часто в качестве доноров и акцепторов используют азот и алюминий соответственно. Основными видами дефектов в объемных монокристаллах SiC являются микропоры, микровключения, дислокации и дефекты упаковки. Упругие напряжения, являющиеся первопричиной появления дислокаций и дефектов упаковки, возрастают при движении от центра к периферии слитка. Нелегированные кристаллы имеют фон остаточных примесей на уровне Ю22 м-3.,Несмотря на большие размеры получаемых подложек площадь реально создаваемых приборов обычно ограничивают величиной 3x3 мм2. Причиной тому являются микропоры, представляющие собой сквозные отверстия диаметром от 0,1 до 5 мкм, которые могут прорастать через весь слиток. Плотность таких дефектов колеблется в пределах 1... 100 см"2. Установлено, что микропоры не «залечиваются» даже на стадии последующей эпитаксии.
Эпитаксия является основным методом формирования приборных структур на подложках SiC. Ее проводят химическим осаждением из газовой фазы при температуре 1 500... 1 600 °С с использованием силана и углеродсодержащего газа (например, пропана С3Н8) в качестве исходных реагентов. По сущности протекающих процессов она подобна эпитаксии кремния. Наряду с эпитаксией для формирования легированных областей применяют ионную имплантацию примесей непосредственно в подложку с последующим термическим отжигом. Высокая сложность и трудоемкость ростовых процессов определяют высокую стоимость монокристаллических подложек SiC и многослойных структур на их основе.
Одна из интересных особенностей карбида кремния заключается в образовании большого числа его кристаллических модификаций — политипов, устойчиво сосуществующих в широком интервале температур. Структура любого политипа SiC может быть представлена трансляцией определенного набора слоев плотней-шей шаровой упаковки, причем в рассматриваемой схеме под «шаром» следует понимать структурную единицу, состоящую из одного атома кремния и одного атома углерода (Si —С). Во взаимном расположении слоев при плотной упаковке шаров в общем случае можно выделить три неэквивалентных положения, которые обозначим символами А, В и С. Политипы различаются порядком чередования и числом слоев А, В, С в «наборе». Например, последовательность АВСАВС... характеризует структуру кубического карбида кремния β-SiC), а чередование АВАВАВ... отражает структуру вюрцита. В последнем случае расположение «шаров» подчиняется схеме плотнейшей гексагональной упаковки с периодом чередования, равным всего лишь двум слоям.
В символической записи политип характеризуется числом слоев в наборе и символом симметрии решетки. Например, в обозначениях политипов ЗС, 2Н, 6Н, 15R, 21 R буквы С, Н и R указывают соответственно на кубическую, гексагональную и ромбоэдрическую симметрию кристаллической решетки. Относительное число гексагональных чередований слоев в структуре политипа называют степенью его гексагональности. Так, в политипе 4 Н, для которого характерна последовательность слоев по типу А В А С... (hchc...), относительное число гексагональных чередований составляет 50 %. Все модификации SiC имеют одинаковую конфигурацию и одинаковый состав первой и второй конфигурационных сфер. Каждый атом решетки тетраэдрически окружен четырьмя атомами другого рода, а вторую координационную сферу составляют 12 атомов того же вида.
Состав более далеких координационных сфер зависит от структуры политипа. В настоящее время известно свыше 150 политипных форм карбида кремния. Однако в действительности их число, по-видимому, не ограничено. По мере совершенствования методики структурного анализа будут выявляться все новые и новые модификации SiC, отличающиеся как числом слоев, так и порядком их укладки в элементарной ячейке.
В противоположность электрофизическим свойствам, физико-механические и химические свойства кристаллов карбида кремния слабо зависят от структуры политипа. Карбид кремния является одним из наиболее твердых веществ (твердость по минералогической шкале составляет 9,5). Он устойчив против окисления до температур свыше 1400 °С. При комнатной температуре карбид кремния не взаимодействует ни с какими кислотами. При нагревании он растворяется в расплавах щелочей, а также реагирует с ортофосфорной кислотой и смесью (HNO3 + HF). Оксидирование монокристаллов SiC не требует разработки специальной технологии и может быть проведено по кремниевой технологии, но при более высоких температурах. Важно подчеркнуть, что в результате окисления на поверхности кристаллов образуется плотная диэлектрическая пленка SiO2. Предел механической прочности массивных монокристаллов α-SiC составляет около 109 Па, а для нитевидных кристаллов с высоким структурным совершенством это значение достигает 20 ГПа. В нормальных условиях все кристаллы SiC обладают примесной электропроводностью. Собственная концентрация носителей заряда при комнатной температуре для разных политипов составляет от 0,1 до 105 м"3, что намного порядков меньше содержания остаточных примесей. Тип электропроводности и окраска кристаллов карбида кремния зависят от вводимых примесей или определяются избытком атомов Si или С над стехиометрическим составом. Чистый карбид кремния стехиометрического состава бесцветен.
Примеси элементов V группы (N, P, As, Sb, Bi) и железа придают карбиду кремния зеленую окраску и электропроводность n-типа, а элементы II (Са, Mg) и III групп (В, А1, Ga, In) — голубую и фиолетовую окраску (в толстых слоях — черную) и электропроводность р-типа. Избыток кремния приводит к электронной электропроводности SiC, а избыток углерода — к дырочной. Собственную электропроводность карбида кремния можно наблюдать начиная с температур 1400...1500°С.
Замечательной особенностью карбида кремния является его способность генерировать излучение в видимой области спектра. Именно с карбидом кремния связано открытие явления электролюминесценции О.Лосевым в 1923 г. Используя различные политипы, а также изменяя примесный состав монокристаллов, в карбиде кремния, в принципе, можно возбуждать люминесценцию с любым цветом свечения — от красн