Контрольные вопросы:
1.Запишите реакцию, лежащую в основе метода йодометрии.
2. В каких случаях метод иодометрии применяется для определения окислителей, а в каких – для определения восстановителей? Приведите примеры.
3. Запишите реакцию взаимодействия йода с тиосульфатом натрия. Уравняйте, применив метод полуреакций.
4. В каких случаях и как проводится метод прямого титрования?
5. Когда в йодометрии применяют метод обратного титрования? В чем он состоит?
6. Почему титрование в методе йодометрии нужно проводить на холоду?
9. Почему титрование в методе йодометрии нельзя вести в щелочной среде? Какая протекает реакция? Как образующийся гипоиодид–ион окисляет тиосульфат–ион? Приведите соответствующие уравнения реакций.
8. Объясните, почему иодометрические определения нужно вести в присутствии избытка иодида калия?
9.Почему титрованные растворы йода необходимо хранить в склянках из темного стекла? По какой реакции иодид калия окисляется кислородом воздуха?
10. Как водный раствор тиосульфат натрия разлагается под действием кислорода воздуха и оксида углерода (IV)?
11. Приведите формулу для расчета массы навески кристаллического тиосульфата натрия для приготовления раствора заданного объема и концентрации.
12. Как можно рассчитать нормальность и титр раствора тиосульфата натрия, используя нормальность и объем раствора йода?
13…
Выполнить упражнения:
1.Допишите реакции и уравняйте, применив метод полуреакций:
А) SО32- + I2 + Н2О →
Б) Sn2+ + I2 →
В) MnО42- + I- + Н+→
Г) СlО3- + Н+ + I- →
2. По приведенным схемам составьте полные уравнения реакций:
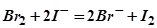 ;
;
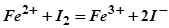 .
.
1. Допишите уравнения реакций:
Na2S2O3 + O2 →
Na2S2O3 + H2CO3→
Тестовые задания:
1. Допишите недостающие составляющие следующих определений:
а) Йодометрией называется метод …..
б) Преимущества метода йодометрии состоят в следующем ….
в) В йодометрии используют следующие способы титрования: ….
2. В основе редоксиметрии лежит реакция:
а) окисления-восстановления;
б) нейтрализации;
в) гидролиза;
г) комплексообразования.
3. Ответьте на вопросы тренировочного теста по данной теме:
1. В йодометрии в качестве индикатора используют:
а) лакмус;
б) фенолфталеин;
в) раствор КМnО4;
г) раствор I2.
2. Титрантом в йодометрии служит:
а) раствор йода в растворе КI;
б) тиосульфат натрия;
в) щавелевая кислота;
г) КМnO4.
3. Выберите вещество для стандартизации титранта I2:
а) Na2S2O3;
б) As2O3;
в) Н2С2О4×2Н2О;
г) Zn (метал.).
4. Титрованным раствором называется раствор с:
а) известной концентрацией;
б) известной массой;
в) известной плотностью;
г) известной температурой кипения.
5. Методы определения окислителей и восстановителей в титриметрии называются:
а) редоксиметрией;
б) комплексонометрией;
в) нейтрализацией.
6. Укажите виды мерной посуды, используемые в титриметрическом анализе для точного измерения объема:
а) мерная колба, колба для титрования, мерный цилиндр;
б) мерная колба, бюретка, градуированная пробирка;
в) мерный цилиндр, мерная колба, бюретка;
г) мерная пипетка, мерная колба, бюретка.
7. Какой реагент называют реактивом Л.А. Чугаева?
А. дитизон;
В. диацетилглиоксим;
С. ализарин;
Д. диметилглиоксим.
8. Укажите соединения, относящиеся к группе экстрагируемых соединений типа ионных ассоциатов, используемые в химическом анализе:
А. I2;
В. Н[FeCl4];
С. дитизонат цинка;
D. [SbCl6]3–*R, где R-катион основного красителя метилового фиолетового.
9. Приведите основные условия экстрагируемости комплексов катионов металлов с органическими реагентами:
А. электронейтральность комплексов;
В. гидратированность комплексов;
С. координационная насыщенность;
Д. низкая температура плавления.
10. Укажите соединения, относящиеся к группе экстрагируемых соединений типа ионных ассоциатов, используемые в анализе:
А. K[I3];
В. [ВF4]– + родамин В;
С. 8 – оксихинолят меди;
Д. [AuCl4]– + метиловый фиолетовый.
11. Из перечисленных ниже формулировок выберите правильную для определения понятия "экстрагент":
А. Раствор реагента, обычно водный, используемый для извлечения веществ из экстракта.
B. Органический растворитель в чистом виде или содержащий реагент, извлекающий вещество из водной фазы.
C. Составная часть экстракта, перешедшая из водной фазы в органическую вместе с извлекаемым веществом.
D. Отделенная водная фаза, содержащая вещество, извлекаемое из экстракта.
12. Из перечисленных ниже формулировок выберите правильную для определения понятия "экстракционный реагент".
A. Раствор реагента, обычно водный, используемый для извлечения веществ из экстракта.
B. Водная фаза, содержащая вещества, извлекаемые из экстракта.
C. Составная часть экстрагента, взаимодействующая с извлекаемым веществом с образованием экстрагирующегося соединения.
D. Органический растворитель в чистом виде или содержащий реагент, извлекающий вещество из водной фазы.
13. Из перечисленных ниже формулировок выберите правильную для определения понятия "реэкстрагент".
A. Органический растворитель в чистом виде или содержащий реагент, извлекающий вещество из водной фазы.
B. Составная часть экстрагента, взаимодействующая с извлекаемым веществом с образованием экстрагирующегося соединения.
С. Отделенная жидкая органическая фаза, содержащая экстрагируемое из водной фазы вещество.
D. Раствор реагента, обычно водный, используемый для извлечения веществ из экстракта.
14. Из перечисленных выше формулировок выберите правильную для определения понятия "экстракт".
A. Органический растворитель в чистом виде, извлекающий вещество из водной фазы.
B. Органический растворитель, содержащий реагент, извлекающий вещество из водной фазы.
C. Отделенная жидкая органическая фаза, содержащая извлеченное из водной фазы вещество.
D. Раствор реагента, обычно водный, используемый для извлечения веществ из экстракта.
15. Из перечисленных выше формулировок выберите правильную для определения понятия "реэкстракт".
A. Органический растворитель в чистом виде, извлекающий вещество из водной фазы.
B. Органический растворитель, содержащий реагент, извлекающий вещество из водной фазы.
C. Отделенная жидкая органическая фаза, содержащая извлеченное из водной фазы вещество.
D. Раствор реагента, обычно водный, используемый для извлечения веществ из экстракта.
Хронометраж 3-х часового занятия:
1. Организационный момент – 2 мин;
2. Пояснения к выполнению работы – 20 мин;
3. Опрос – 30 мин;
4. Выполнение и оформление работы – 60 мин;
5. Проверка работ и задание на дом –23 мин.
Литература:
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: учеб. Пособие для студентов мед. спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 1993.
3. Селезнев К.А. Аналитическая химия. М., 1966.
4. Крешков А.П. Основы аналитической химии. Кн. 2. М.: Химия.
Задания для самостоятельной работы по изучаемой теме:
I.
1.Запишите реакцию, лежащую в основе метода йодометрии.
2. В каких случаях метод иодометрии применяется для определения окислителей, а в каких – для определения восстановителей? Приведите примеры.
3. Запишите реакцию взаимодействия йода с тиосульфатом натрия. Уравняйте, применив метод полуреакций.
4. Допишите реакции и уравняйте, применив метод полуреакций:
А) SО32- + I2 + Н2О →
Б) Sn2+ + I2 →
В) MnО42- + I- + Н+→
Г) СlО3- + Н+ + I- →
5. Какие продукты образуются при взаимодействии бихромата калия с иодидом калия в сернокислой среде? Напишите уравнение соответствующей реакции.
1. По приведенным схемам составьте полные уравнения реакций:
 ;
;
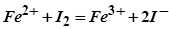
6. В каких случаях и как проводится метод прямого титрования?
7. Когда в йодометрии применяют метод обратного титрования? В чем он состоит?
2. Какой способ титрования применяют в йодометрии для определения окислителей? Опишите его.
II.
1. Почему титрование в методе йодометрии нужно проводить на холоду?
2. Почему титрование в методе йодометрии нельзя вести в щелочной среде? Какая протекает реакция? Как образующийся гипоиодид–ион окисляет тиосульфат–ион? Приведите соответствующие уравнения реакций.
3. Объясните, почему иодометрические определения нужно вести в присутствии избытка иодида калия?
4. Почему титрованные растворы йода необходимо хранить в склянках из темного стекла? По какой реакции иодид калия окисляется кислородом воздуха?
5. Сравните точность метода йодометрии с другими окислительно–восстановительными методами.
6. Обязательно ли применение индикаторов в методе йодометрии? Почему?
7. Почему возможно применение неводных растворов в методе йодометрии?
8. Как водный раствор тиосульфат натрия разлагается под действием кислорода воздуха и оксида углерода (IV)? Допишите уравнения реакций:
Na2S2O3 + O2 →
Na2S2O3 + H2CO3→
9. Приведите формулу для расчета массы навески кристаллического тиосульфата натрия для приготовления раствора заданного объема и концентрации.
10. Как можно рассчитать нормальность и титр раствора тиосульфата натрия, используя нормальность и объем раствора йода?
11. Приведите уравнение реакции, по которому реагируют бихромат калия и иодид калия в кислой среде.