Цель занятия. Ознакомиться с физическим (ареометрическим) методом анализа. Освоить технику подбора ареометра для нахождения относительной плотности рассола соли и определения с последующим пересчетом на содержание соли по специальной таблице, приобретение навыков приготовления растворов различной концентрации из сухой соли или более концентрированного раствора.
Методы количественного анализа, позволяющие определить состав анализируемого вещества, не прибегая к использованию химических реакций, называют физическими методами анализа. При использовании физических методов для определения состава анализируемого вещества оказывается достаточным измерить показатели каких-либо физических свойств, например коэффициент лучепреломления, электро- или теплопроводность, разность потенциалов электродов и т.п. Так, определив плотность раствора кислоты или щелочи, можно найти по соответствующим справочным таблицам процентное содержание их в данном растворе.
Ареометрический метод измерения плотности жидких и твердых веществ основан на взвешивании тела известного объема в воздухе, а затем в исследуемой жидкости. Разность веса, численно равная весу вытесненной жидкости, разделенная на объем вытесненной жидкости соответствует измеряемой плотности вещества, или плотностью раствора ρ называют отношение массы вещества m к его объёму V:
ρ = m / V
Этот метод (ареометрический) отличается простотой и быстротой определения. Плотность этим методом можно определять лишь с точностью до третьего десятичного знака.
По плотности растворов можно определить содержание растворимых сухих веществ. Зная плотность раствора, легко определить массу растворенного вещества по его объему. Точно измерить объем не всегда возможно, поэтому чаще всего определяют массу такого же объёма воды. Зная плотность воды, легко вычислить её объём. раствора при 200 С.
Отношение плотности анализируемого вещества ρ к плотности воды ρ0 называется относительной плотностью. Если отнести массу раствора при 200 С к массе воды при 40С, т.е. максимальной плотности воды, равной 1, то получим истинную плотность. Плотность раствора меняется в зависимости от его концентрации. Следовательно, для каждого вещества определенной плотности его раствора отвечает определенная концентрация.
Так, например, сущность физического метода определения содержания соли заключается в определении относительной плотности рассола ареометром с последующим пересчетом на содержание соли по специальной таблице. Метод не очень точный, т.к. относительная плотность рассола обусловлена содержанием не только соли, но и других растворенных веществ (кислот, минеральных солей и др.). Однако в связи с тем, что раствор соли в большей степени влияет на относительную плотность, прочие растворенные вещества условно не учитываются.
Для быстрого, но приближенного определения плотности служит ареометр. Ареометры предназначены для измерения плотности, относительной плотности и концентрации веществ в двухкомпонентных растворах различных жидкостей в диапазоне от 600 до 1840 кг/м3. Ареометры, шкала которых отградуирована в единицах плотности, называются денсиметрами. Он представляет собой поплавок с дробью или ртутью и узким отростком- трубкой, в которой находиться шкала с делениями. Ареометр погружается в различных жидкостях на различную глубину. При этом он вытесняет объёмы этих жидкостей одной и той же массы, равной массе ареометра, а следовательно обратно пропорциональные их плотности. Чем глубже погружается ареометр в жидкость, тем меньше плотность раствора. То деление шкалы, до которого ареометр погружается в жидкость, показывает плотность этой жидкости. В зависимости от заданной точности применяют или один ареометр с большими интервалами на шкале или набор нескольких ареометров с мелкими делениями.

От плотности раствора можно перейти к процентному содержанию, пользуясь специальными таблицами. Если в таблицах не имеется цифры, точно отвечающей сделанному отсчету на шкале ареометра, а есть близкие величины (немного больше и немного больше), то процентное содержание растворенного вещества вычисляют методом интерполяции (определение промежуточной величины по двум известным крайним). Предположим, что имеется раствор серной кислоты с плотностью 1,200. По табл. находим, что для растворов серной кислоты с плотностью 1,174 и 1,205 процентная концентрация соответственно равна 24 и 28%. Считаем, что в этих интервалах процентное содержание изменяется прямо пропорционально изменению плотности. Разница плотностей равна 1,025-1,174=0,031, а разница в процентном содержании составляет 28%-24%=4%. Находим разницу между плотностью нашего раствора и плотностью раствора кислоты с меньшей концентрацией. Она равна 1,200-1,174=0,026. Увеличению плотности на 0,031 соответствует увеличение процентного содержания, соответствующее увеличению плотности на 0,026 находим из пропорции:
0,031/0,026=4/х; х=4  0,026/0,031=3,35%
0,026/0,031=3,35%
Найденную величину прибавляем к процентному содержанию кислоты в растворе с меньшей плотностью и получаем искомое процентное содержание: 24%+3,35%=27,35%
С изменением концентрации плотность изменяется не всегда прямо пропорционально процентному содержанию. Поэтому приведенный расчет дает результат лишь приблизительный, но для практических целей достаточно точный.
ЛАБОРАТОРНАЯ РАБОТА
ОПЫТ 1. ПРИГОТОВЛЕНИЕ РАСТВОРА ХЛОРИДА НАТРИЯ С ЗАДАННОЙ МАССОВОЙ ДОЛЕЙ СОЛИ (%) РАЗБАВЛЕНИЕМ КОНЦЕНТРИРОВАННОГО РАСТВОРА.
В ыполнение опыта. В мерный цилиндр наливают раствор хлорида натрия и ареометром определяют его плотность. По таблице 1 находят концентрацию исходного раствора [ в % (масс) ].
Таблица 1.
Плотность и процентное содержание растворов хлорида натрия.
| Концентрация, % | Плотность*10-3, кг/м3, при температуре | Концентра-ция, % | Плотность*10-3, кг/м3, при температуре | ||
| 100С | 200С | 100С | 200С | ||
| 1,0071 | 1,0053 | 1,1049 | 1,1008 | ||
| 1,0144 | 1,0125 | 1,1127 | 1,1065 | ||
| 1,0218 | 1,0196 | 1,1206 | 1,1162 | ||
| 1,0292 | 1,0268 | 1,1285 | 1,1241 | ||
| 1,0366 | 1,0340 | 1,1364 | 1,1319 | ||
| 1,0441 | 1,0413 | 1,1445 | 1,1398 | ||
| 1,0516 | 1,0486 | 1,1525 | 1,1478 | ||
| 1,0591 | 1,0559 | 1,1607 | 1,1559 | ||
| 1,0666 | 1,0633 | 1,1689 | 1,1639 | ||
| 1,0742 | 1,0707 | 1,1772 | 1,1722 | ||
| 1,0819 | 1,0782 | 1,1856 | 1,1804 | ||
| 1,0895 | 1,0857 | 1,1940 | 1,1888 | ||
| 1,0972 | 1,0933 | 1,2025 | 1,1972 |
Рассчитывают, сколько миллилитров исходного раствора и воды следует взять для приготовления 250 мл 5% раствора. Воду отмерить цилиндром и вылить в мерную колбу объемом 250мл. Исходный раствор поваренной соли отмеряют цилиндром на 100 мл и вливают в колбу с водой. Раствор в колбе перемешивают. Цилиндр ополаскивают небольшим объемом раствора из колбы, который затем присоединяют к общей массе раствора в колбе. Проверить плотность и концентрацию полученного раствора. Рассчитать относительную ошибку δотн
δотн =  %,
%,
где С – заданная концентрация,
С 1- полученная концентрация.
Сделайте расчет молярной концентрации молярной концентрации эквивалентов и титра, приготовленного раствора. Результаты запишите в таблицу 2.
Таблица 2.
Опытные данные
| Заданная массовая доля, (%) | Плотность,ρ, кг/м3 | Рассчитанные массы компонентов, г | Плотность экспериментальная, ρ, кг/м3 | Экспериментальные концентрации | δотн | |||||
| NaCl | H2O | |||||||||
| с, % | с, М | сэк, н | T, г/мл | |||||||
ПРИМЕР 1.Приготовить 0,5 л 20% раствора H2SO4, исходя из концентрированного раствора, плотность которого 1,84 г/см3.
По таблице находим, что плотности 1,84 г/см3 соответствует кислота с содержанием 96% H2SO4, а 20% раствору соответствует кислота с плотностью 1,14 г/см3.
Вычислим количества исходной кислоты и воды, требующиеся для получения заданного объема раствора.
Масса его составляет 500  1,14 = 570 г, а содержание в нем H2SO4 равно
1,14 = 570 г, а содержание в нем H2SO4 равно
 г.
г.
Вычислим, в каком объеме исходной 96% кислоты содержится 114 г H2SO4:
1 мл исходной кислоты содержит  г H2SO4
г H2SO4
 х мл исходной кислоты содержит 114 г H2SO4
х мл исходной кислоты содержит 114 г H2SO4
 мл
мл
Таким образом, для приготовления 500мл 20% раствора H2SO4 необходимо взять 64,6 мл 96% раствора.
Количество воды определяется как разность весов полученного исходного раствора, а именно мл

ОПЫТ 2. ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ СМЕШИВАНИЕМ РАСТВОРОВ БОЛЕЕ ВЫСОКОЙ И БОЛЕЕ НИЗКОЙ КОНЦЕНТРАЦИИ.
Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
ПРИМЕР 2. Приготовить 100г 36% раствора H3PO4, смешав 44% и 24% растворы этой кислоты.
I СПОСОБ РАСЧЕТА:
Обозначим через х количество граммов 44% раствора, которое следует добавить к (100-х) граммам 24% раствора для получения 100г 36% раствора H3PO4. Составим уравнение:

откуда 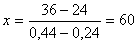
Следовательно, необходимо взять 60г 44% раствора 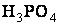 и 100 - х = 40г 24% раствора.
и 100 - х = 40г 24% раствора.
II СПОСОБ РАСЧЕТА:
Он называется "правилом креста". Если в левый угол воображаемого прямоугольника поместить более высокую концентрацию – 44, а в нижний левый – меньшую концентрацию –24, а в центре - концентрацию получаемого смешанного раствора – 36 и затем вычесть по диагонали из большего числа меньшее, то отношение разностей 12: 8 = 3: 2 покажет в каком весовом соотношении следует смешать исходные растворы для получения раствора заданной концентрации.
Так, для получения 100г 36% раствора достаточно смешать 60г 44% раствора и 40 г 24% раствора.

Определив по таблице плотности исходных растворов – 1,285 г/см3 (для 24% раствора) находим, что объемы их соответственно составляют:
 мл 44% раствора H3PO4
мл 44% раствора H3PO4
 мл 24% раствора H3PO4
мл 24% раствора H3PO4
В общей форме "правило креста" имеет вид:

где а и в соответственно большая и меньшая исходные концентрации;
с - концентрация смешанного раствора;
 - показывает, в каком массовом соотношении следует смешать исходные растворы.
- показывает, в каком массовом соотношении следует смешать исходные растворы.
Выполнение опыта. Приготовить 250 мл 10 % раствора хлорида натрия, имея в своем распоряжении 15 % и 5 % раствор NaCl.
Учитывая плотности приготовляемого и исходных растворов рассчитать объемы 15 % и 5 % раствора (см. пример 2). Отмерить вычисленные объемы исходных растворов, слить в колбу на 250 мл, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном. Отлить часть раствора в цилиндр, измерить ареометром плотность приготовленного раствора и по табл.1 найти его концентрацию (в %). Установить расхождение практически полученной концентрации с заданной. Рассчитать относительную ошибку δотн.
ОПЫТ 3. ПРИГОТОВЛЕНИЕ ВОДНОГО РАСТВОРА ХЛОРИДА НАТРИЯ. ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ И РАСЧЕТ НАВЕСКИ.
Получить навеску соли хлорида натрия у преподавателя. При помощи воронки перенести данную навеску в мерную колбу емкостью 250 мл. Промывалкой обмыть внутреннюю часть воронки небольшим количеством воды. Растворить соль в воде. Затем, добавляя воду небольшими порциями, довести уровень воды в колбе до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая вверх дном. Замерить плотность полученного раствора ареометром. Для этого раствор перелить в мерный цилиндр. Уровень жидкости должен быть ниже края цилиндра на 3-4 см. Осторожно опустите ареометр в раствор. Ареометр не должен касаться стенок цилиндра. Отсчет плотности по уровню жидкости производите сверху вниз. По таблице 1 найдите и запишите массовую долю (в %) раствора, отвечающую этой плотности. Рассчитать количество хлорида натрия взятого для приготовления 250 мл раствора.
ПРИМЕР. Пусть плотность приготовленного раствора хлорида натрия ρ=1,0053г/см3 . Это соответствует 1% концентрации раствора. Следовательно, в100г раствора содержится 1г NaCl. Определим массу 250 мл раствора
 =
= 
Исходя из того, что в 100г раствора содержится 1г NaCl, узнаем, сколько грамм NaCl содержится в 201,315г раствора:
100 г раствора - 1 г NaCl
201,315 г раствора - х г NaCl
х =  г NaCl
г NaCl
Таким образом, была взята навеска NaCl массой 2,0131 г.
ОПЫТ 4. ОПРЕДЕЛЕНИЕ ОТНОСИТЕЛЬНОЙ ПЛОТНОСТИ РАССОЛА СОЛИ И ОПРЕДЕЛЕНИЕ ЕГО МАССОВОЙ ДОЛИ
В цилиндр на 100 или 200 мл (в зависимости от внешних параметров ареометра) наливают заранее отфильтрованный рассол. Уровень жидкости должен быть таким, чтобы помещенный в цилиндр ареометр не касался дна и стенок, а свободно плавал. После этого замеряют относительную плотность рассола, отмечая количество делений на шкале ареометром по верхней части мениска жидкости. Устанавливают температуру рассола и делают пересчет, для чего поправка 0,00045 умножается на количество градусов, на которое фактическая температура рассола отличается от 200С, (t=200 С ± фактическая температура). Полученное значение прибавляют к относительной плотности, если температура выше 200 С, и отнимают при пониженных температурах.
Необходимость введения поправки вызвана тем, что относительная плотность и температура находятся в обратной зависимости, а шкала ареометра рассчитана на измерении относительной плотности растворов при температуре 200С.
Рассчитав фактическую относительную плотность, определяют по таблице 1 содержание соли. Если фактическая относительная плотность не совпадает с данными таблицы, то делают пересчет.
Табл. 1 Зависимость между относительной плотностью рассола и содержанием соли.
| Отн.плотность | 1,0053 | 1,0125 | 1,0196 | 1,0268 | 1,0340 | 1,0413 | 1,0486 |
 , % , %
|
Пример:
Относительная плотность определяемого рассола – 1,0150 г/см3. Составляем пропорцию из ближайших табличных значений.
1,0196 - 3%
1,0125 – 2%
0,0071 – 1%
1,016 – 1,0125 = 0,0025
0,0071 – 1%
0,0025 – х х=0,4%
2+0,4 = 2,4% - содержание соли, соответствующее относительной плотности 1,0150 г/см3.
Вопросы и задания:
1. Что называют растворами?
2. Какой раствор называют насыщенным, ненасыщенным, пересыщенным?
3. Дайте определение величине, называемой концентрацией раствора. Запишите известные вам формулы выражения концентраций растворов, укажите все величины, присутствующие в них и единицы их измерений.
4. Сделать расчет для приготовления 250 мл 1М раствора серной кислоты из раствора, имеющегося в лаборатории.
5. Сделать расчет для приготовления 250 мл 10% раствора кислоты из имеющегося в лаборатории раствора.
6. Сделать расчет для приготовления 200 мл раствора гидроксида натрия (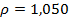 ) из концентрированного раствора.
) из концентрированного раствора.
Задания для самостоятельной работы по изучаемой теме:
- 10 г нитрата калия растворено в 80 г воды. Определите процентную концентрацию полученного раствора.(11 % раствор)
- Какую массу нитрата серебра надо растворить в 250 г воды для получения 2 % - ого раствора?(5 г соли)
- Сколько грамм CuSO4
 5H2O и воды потребуется для приготовления 200 г 5 % - ого раствора сульфата меди (II), рассчитанного на безводную соль? (15,6 г CuSO4
5H2O и воды потребуется для приготовления 200 г 5 % - ого раствора сульфата меди (II), рассчитанного на безводную соль? (15,6 г CuSO4  5H2O; 184,4г воды)
5H2O; 184,4г воды) - Сколько грамм фосфорной кислоты нужно для приготовления 100 мл 0,02 Н раствора? (0,065 г)
- Сколько грамм тиосульфата натрия (кристаллогидрата) нужно для приготовления 250 мл 0,1 М раствора? (5,95 г кристаллогидрата)
- Определите нормальную концентрацию 20 % - раствора серной кислоты, если
 = 1,14 г/см3. (4,65 Н раствор кислоты)
= 1,14 г/см3. (4,65 Н раствор кислоты) - 66,8 г серной кислоты растворено в 133,2 г воды. Плотность полученного раствора равна 1,25 г/см3. Определите: а) массовую долю раствора; б) молярную концентрацию раствора; в) нормальную концентрацию раствора. (а) 33,4%; б) 4,26 М раствор; в) 8,6 Н раствор)
- Какие объёмы 37 % - ого раствора соляной кислоты (
 ) воды нужны для приготовления 1 л 10 %-ого раствора (
) воды нужны для приготовления 1 л 10 %-ого раствора ( =1,049 г/см3)? (238 мл соляной кислоты, 765,5 см3 воды)
=1,049 г/см3)? (238 мл соляной кислоты, 765,5 см3 воды) - Какой объём 68 % - ого раствора азотной кислоты (
 =1,4 г/см3) потребуется для приготовления 50 мл 2Н раствора? (6,6 мл)
=1,4 г/см3) потребуется для приготовления 50 мл 2Н раствора? (6,6 мл)
Хронометраж 2-часового занятия:
1.Организационный момент – 3 мин.
2. Объяснение нового материала- 30 мин.
3. Выполнение лабораторной работы-40 мин.
4. Письменный тестовый опрос- 15 мин.
5. Задание на дом- 2 мин.
Литература:
1. М.И. Равич-Щербо, В.В. Новиков. Физическая и коллоидная химия. М.1975г., глава IV, с. 88-89.
2. П.М. Маршев. Руководство к практическим занятиям по физической и коллоидной химии. Медиздат, 1954г., с. 54-56.