Внутренняя энергия U обладает свойством аддитивности, согласно которому внутренняя энергия сложной системы равна сумме внутренних энергий входящих в нее частей: U = ∑ Uj, где j = 1, 2... - порядковые номера частей системы. Измеряется U в Дж.
Внутренняя энергия u = U / m, отнесенная к единице массы вещества, называется удельной внутренней энергией и измеряется в Дж/кг. В дальнейшем для краткости величину u будем называть просто внутренней энергией. Внутренняя энергия относится к числу калорических параметров состояния, поэтому du является полным дифференциалом. В соответствии с этим изменение внутренней энергии в процессе целиком определяется ее значениями в начальном (и 1) и конечном (и 2) состоянии и не зависит от пути процесса. Изменение внутренней энергии в цикле равно нулю:
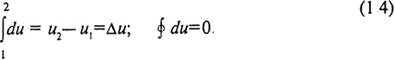
Для практических расчетов за начало отсчета внутренней энергии может быть принято любое состояние вещества.
Внутренняя энергия может быть выражена как функция любой пары основных термических параметров. Зависимости такого рода называются калорическими уравнениями состояния. Наиболее употребительным является калорическое уравнение в переменных v и Т:

В соответствии с современными представлениями о микроструктуре вещества внутренняя энергия тела складывается из внутренней кинетической энергии u к, внутренней потенциальной энергии и п и нулевой энергии u 0:

Внутренняя кинетическая энергия определяется поступательным и вращательным движением молекул и колебательным движением атомов в молекуле. Она является функцией абсолютной температуры, u к = f (T). Внутренняя потенциальная энергия определяется силами взаимодействия между молекулами. Величина этих сил зависит от расстояния между молекулами, т. е. от удельного объема вещества. Следовательно, u п = f (v). Сумму внутренней кинетической и потенциальной энергии часто называют тепловой энергией. Именно в этом смысле понятие тепловой энергии широко используется в технической и справочной литературе. Нулевая энергия определяется силами внутримолекулярного, внутриатомного и внутриядерного взаимодействия. В процессах, не связанных с химическими и ядерными превращениями, нулевая энергия остается постоянной, а изменяется только тепловая часть внутренней энергии.
Непрерывность действия тепловых машин, аппаратов и установок чаще всего обеспечивается при использовании потоков рабочих тел, что соответствует принципу открытой термодинамической системы. Такая система (см. рис. 1, б) обменивается с окружающей средой не только теплотой и работой, но и веществом. Изменение состояния массы вещества в выбранных границах открытой системы происходит одновременно с перемещением этой массы в результате упругого взаимодействия со смежными массами внешнего потока на границах системы. Каждая единичная масса вещества, движущегося в канале, стремится вытолкнуть впереди идущую единичную массу за счет потенциальной энергии давления, полученной потоком в начале пути (от насоса, компрессора и т. п.). Следовательно, изменение состояния и перемещение массы вещества в открытой системе органически связано с перемещением смежных масс внешнего потока, движущихся впереди и позади системы. Поэтому, в отличие от внешнего взаимодействия системы с окружающей средой в форме работы и теплоты, упругое взаимодействие с внешним потоком является для системы внутренним процессом, в связи с чем открытую систему называют еще расширенной термодинамической системой.
При неразрывном установившемся движении потока массовый расход вещества G (в кг/с) в любом сечении системы и на ее границах одинаков и может быть определен по уравнению неразрывности (или сплошности):

где f - сечение канала, м2, с - скорость потока, м/с.
Потенциальная энергия давления Е д, полученная потоком в начале пути, переносится потоком и затрачивается на его перемещение по каналу. Для единичной массы вещества (G = 1 кг/с) эта энергия е д может быть определена как работа проталкивания через рассматриваемое сечение и выражена как произведение силы на перемещение. Например, для сечения f 1 (рис. 1, б) на входе в систему при перемещении х 1, е = р 1 х 1 = р 1 v 1 где р 1 f 1 - сила, a f 1 x 1 = v 1 - удельный объем. Для произвольного сечения канала

Следовательно, энергия давления определяется параметрами состояния потока и составляет неотъемлемую часть его энергии, поэтому для потока вещества определяющим параметром будет уже не внутренняя энергия, а сумма удельной внутренней энергии и энергии давления, называемая энтальпией i. Удельная энтальпия (в Дж/кг)

Энтальпия обладает свойством аддитивности. Для произвольной массы вещества I = mi = U + pV; I = ∑ Ij. В соответствии с уравнением (1.9) энтальпия является параметром состояния, поскольку представляет собой комбинацию величин - параметров состояния. Элементарное изменение энтальпии di является полным дифференциалом, а изменение энтальпии в процессе не зависит от пути процесса и определяется ее значениями в начальном и конечном состоянии. Изменение энтальпии в круговом процессе равно нулю.
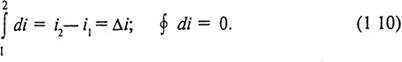
За начало отсчета энтальпии может быть принято любое состояние вещества. Энтальпия относится к числу калорических параметров состояния и может быть представлена как функция любой пары термических параметров. Наиболее употребительным является калорическое уравнение в переменных р и Т:

Контрольные вопросы и примеры к 1-й главе
1. Что изучает термодинамика?
2. Каковы задачи технической термодинамики?
3. Как классифицируются виды энергии в термодинамике?
4. Что такое теплота?
5. Что такое работа?
6. Какое различие между функцией состояния и функцией процесса?
7. Что называется термодинамической системой?
8. Как взаимодействует неизолированная система с окружающей средой?
9. Чем отличается открытая система от закрытой?
10. Какие величины называют термодинамическими параметрами?
11. Какие параметры относятся к термическим и какие к калорическим?
12. Что называется термическим уравнением состояния?
13. Какое уравнение состояния называют калорическим?
14. Что такое термодинамическое равновесие?
15. Какой процесс называют обратимым?
16. Какой процесс называют необратимым?
17. Что такое внутренняя энергия?
18. Что такое энтальпия?
Пример 1.1. Избыточное давление в барабане парового котла, измеряемое пружинным манометром, р и = 2500 кПа. Барометрическое давление по ртутному барометру p бар = 765 мм рт. ст. при температуре 0°С. Определить абсолютное давление в барабане котла.
Решение. При 0°С 1 мм рт. ст. соответствует 133,32 Па (см. табл. 1 в Приложении), поэтому p бар = 765 133,32 = 101991,33 Па ≈ 102 кПа. Абсолютное давление р = p и + p бар 2500 + 102 ≈ 2602 кПа (26,02 бар).
Пример 1.2. Ртутный вакуумметр, присоединенный к конденсатору, показывает разрежение р в = 280 мм. рт. ст. при температуре 40°С. Атмосферное давление, определяемое ртутным барометром при температуре 30°С, составляет p бар = 760 мм. рт. ст. Определить абсолютное давление в конденсаторе.
Решение. Предварительно приведем показания ртутных приборов к 0°С (см. табл. 1 в Приложении):

Абсолютное давление в конденсаторе p = p бар - p в = 755,3184 - 278,0736 = 477,2448 мм рт. ст. = 63,628 Па = 63,63 кПа = 0,6363 бар.