В термодинамической системе, находящейся в состоянии равновесия, отсутствует перемещение отдельных ее частей и нет теплообмена между ними и с окружающей средой. Любая система, находящаяся в неизменных внешних условиях (например, изолированная), приходит в состояние термодинамического равновесия независимо от своего начального состояния. Выйти из этого состояния равновесия без изменения внешних параметров система не может.
Для неизолированной системы понятие термодинамического равновесия предполагает и равновесие с окружающей средой. Например, при независимых параметрах p и T (рис. 1, а) это означает, что р = p ' (динамическое равновесие) и Т = Т ' (термическое равновесие). Если р ≠ р ' или Т ≠ T, то имеет место обмен энергией с окружающей средой в форме работы или теплоты. При таком обмене параметры системы изменяются во времени. Изменение параметров начинается на границе с окружающей средой и постепенно распространяется на внутренние части системы. Поэтому в каждый момент времени параметры в разных точках системы неодинаковы, т. е. система находится в неравновесном состоянии. При изменении параметров окружающей среды состояние находившейся с ней в равновесии неизолированной системы будет также изменяться. В результате, пройдя через ряд промежуточных состояний, система придет в новое равновесное состояние, соответствующее изменившимся параметрам окружающей среды. Совокупность промежуточных состояний при переходе системы из одного равновесного состояния в другое называется термодинамическим процессом.
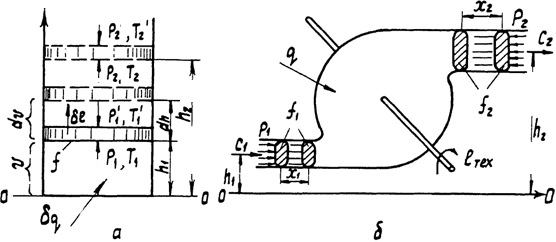
Рис. 1. Схемы простейших термодинамических систем: а - закрытой; б – открытой
Процесс называется равновесным, если состоит из совокупности равновесных состояний, и неравновесным, если состоит из совокупности неравновесных состояний. Все реальные процессы неравновесны, так как протекают с конечными скоростями. Например, при расширении газа в цилиндре (см. рис. 1, а) давление будет разным в различных сечениях по высоте; меньше всего оно будет в зоне, прилегающей к поршню. Равновесный процесс является идеальным, так как осуществить его можно лишь при бесконечно медленном изменении параметров окружающей среды и системы. Равновесный процесс может быть изображен графически линией на термодинамической поверхности.
Равновесный процесс, протекающий при отсутствии трения, называется обратимым. Под трением в широком смысле слова здесь понимается любой процесс непосредственного превращения различных видов энергии в тепловую. Обратимый процесс может протекать самопроизвольно как в прямом, так и в обратном направлении, проходя через те же самые равновесные состояния. В результате прямого и обратного процессов термодинамическая система и окружающая среда возвращаются в исходное состояние без остаточных изменений. Это означает, что на сжатие будет затрачена точно такая же работа, что и полученная при расширении; теплота, отведенная при сжатии и подведенная при расширении, будет одинаковой.
Необратимым называется процесс, который либо вообще невозможен в обратном направлении по тому же самому пути, либо требует для своего осуществления дополнительных внешних затрат. Если нарушается хотя бы одно из условий обратимости, то процесс будет необратимым. Необратимыми являются все реальные процессы, поскольку они протекают с трением, в условиях динамического и термического неравновесия. Например, процесс теплообмена между двумя телами при конечной разности температур (Т ≠ T ') самопроизвольно идет лишь в одном направлении: теплота передается от тела более нагретого к телу менее нагретому до достижения температурного равновесия между ними. Для осуществления обратного процесса потребовалось бы за счет затрат извне нагреть прежде менее нагретое тело до первоначальной температуры более нагретого тела. Перемещение газа из области более высокого давления в область более низкого (р ≠ р ') является необратимым, так как обратное перемещение требует дополнительной работы извне. При расширении с трением часть работы затрачивается на его преодоление и идет на пополнение запаса тепловой энергии (δ l тр = δ q тр), поэтому оставшейся части работы уже не хватает для осуществления обратного процесса сжатия до первоначального давления.
Обратимый процесс является идеальным, но он более прост и удобен для термодинамического анализа, поэтому техническая термодинамика занимается изучением прежде всего обратимых процессов. Влияние необратимости учитывается с помощью опытных поправок и коэффициентов. Это позволяет оценивать степень необратимости того или иного процесса по отношению к обратимому процессу в зависимости от величины дополнительных внешних затрат (например, работы) для возвращения системы в исходное состояние.
Графическое изображение обратимых (равновесных) процессов на термодинамической поверхности в пространстве сложно. Поэтому принято изображать их на плоскости в системе координат двух любых независимых параметров. Такие системы координат называются диаграммами состояния вещества. Например, на рис. 2 изображены термодинамические процессы в диаграмме p - v. Изображение необратимых процессов на диаграммах состояния может быть лишь условным.
В общем случае термодинамического процесса (подводится или отводится теплота, совершается или затрачивается работа) изменяются все параметры состояния. Наибольшее практическое и теоретическое значение имеют изохорный (v = const), изобарный (р = const), изотермический (Т = const) и адиабатный (δ q = 0) процессы, а для идеального газа еще и политропный процесс (при постоянной теплоемкости). Особая роль отводится циклам (круговым процессам), в результате которых система, пройдя через ряд промежуточных состояний, возвращается в исходное. Цикл считается обратимым, если все составляющие его процессы обратимы. Если хотя бы один из процессов необратим, то весь цикл считается необратимым. Обратимые циклы изображаются графически замкнутыми линиями (рис. 2, б).
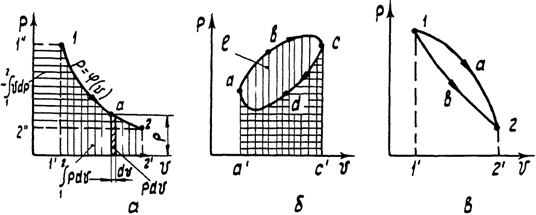
Рис. 2. Рабочая диаграмма: а - определение работы процесса; б - определение работы цикла; в - зависимость работы от пути процесса