Теплообмен системы с окружающей средой в общем случае сопровождается изменением температуры, поэтому количество теплоты в каком-либо процессе часто выражают через изменение температуры тел в этой системе.
Количество теплоты, которое нужно подвести (или отвести) в данном процессе для изменения температуры тела на 1 К, называют теплоемкостью. В технической термодинамике удобнее всего использовать понятие удельной теплоемкости: массовой сx, отнесенной к 1 кг вещества и измеряемой в Дж/(кг∙К); молярной μ сx, отнесенной к 1 молю вещества и измеряемой в Дж/(моль∙К); объемной с'x, отнесенной к 1 м3 вещества при нормальных физических условиях и измеряемой в Дж/(м3∙К). Связь между указанными удельными теплоемкостями определяется соотношением

где μ - молярная масса, кг/моль; v 0 - удельный объем при нормальных физических условиях, м3/кг.
(В дальнейшем будем пользоваться преимущественно понятием массовой теплоемкости).
Теплоемкость является функцией процесса, т. к. для изменения температуры тела на 1 К в различных процессах требуется разное количество теплоты. Числовое значение теплоемкости в различных процессах может изменяться от - ∞ до = + ∞. Индекс х в обозначении теплоемкости в каждом конкретном случае указывает на условия протекания процесса. Например, теплоемкость процесса постоянного давления обозначается cp теплоемкость процесса постоянного объема - cv. Теплоемкости этих двух процессов наиболее изучены и чаще всего используются в расчетах.
Теплоемкости реальных процессов изменяются в зависимости от параметров процесса. Чаще всего эту зависимость выражают в переменных p и Т: cx = f (p, T). Теплоемкость в данной точке процесса называют истинной теплоемкостью и определяют по изменению температуры в элементарном процессе

Следовательно, теплота процесса является его функцией и может быть выражена через истинную теплоемкость этого процесса
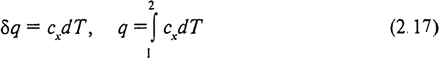
Истинные теплоемкости реальных газов сp; cv; μ cp; μ cv; c ' p; c ' v определяются экспериментально; их значения приводятся в специальных таблицах.
Для интегрирования уравнения (2.17) необходимо знать, как изменяется в данном процессе теплоемкость сx в зависимости от температуры. Эту зависимость иногда трудно выразить аналитически, поэтому на практике для определения теплоты пользуются понятием средней теплоемкости процесса сxm в заданном интервале изменения температуры
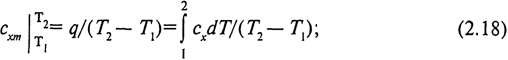
Если известна средняя теплоемкость процесса, то

Значение средних теплоемкостей сpm; cvm; (μ cp) m; (μ cv) m; c ' pm; c ' vm; для реальных газов также определяются экспериментально и приводятся в специальных таблицах для интервала температур от 0 °С до t °C - сxm |
| t |
. Тогда теплоту процесса можно выразить через табличные значения средних теплоемкостей

§ 10. АНАЛИТИЧЕСКИЕ ВЫРАЖЕНИЯ ПЕРВОГО ЗАКОНА
ТЕРМОДИНАМИКИ
Для возможности исследования различных термодинамических систем уравнение первого закона в общем виде (2.4) необходимо преобразовать с учетом термодинамической классификации видов энергии и определения работы процесса. Такое преобразование осуществляют в двух вариантах: для открытой и закрытой термодинамических систем.
В условиях открытой термодинамической системы (см. рис. 1, б) при установившемся движении потока изменение его энергии будет складываться в общем случае из изменения внутренней энергии, внешней потенциальной энергии давления, внешней потенциальной энергии положения и кинетической энергии. Для единичного массового расхода
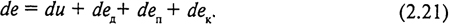
Под внешней работой понимается техническая работа

В результате подстановки (2.21) и (2.22) в уравнение (2.4) с использованием соотношений (1.8) и (2.13) получим развернутое уравнение первого закона термодинамики, справедливое для обратимых и необратимых процессов:
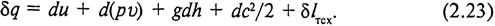
Сумма первых двух слагаемых в правой части уравнения (2.23) представляет собой изменение энтальпии: du + d (pv) = d (u + pv) = di, сумма остальных трех слагаемых в соответствии с (2.14) - располагаемую работу δ l 0. Поэтому уравнение первого закона термодинамики для открытой системы можно представить в более простой форме:
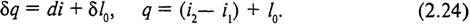
Таким образом, теплота, подведенная к потоку, в общем случае расходуется на изменение его энтальпии и на располагаемую работу.
Для обратимых процессов δ l 0 = - vdp, поэтому
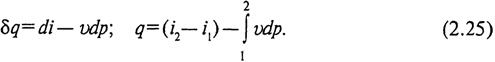
Это уравнение является наиболее удобным при анализе процессов в открытых системах.
Для закрытых систем (рис. 1, а) уравнение первого закона термодинамики удобнее представить через изменение внутренней энергии. Если в (2.23) три последних слагаемых представить как располагаемую работу, то для обратимых процессов можно записать
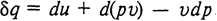
Поскольку d (pv) = pdv + vdp, окончательно получим
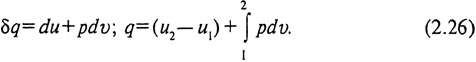
Второе слагаемое в (2.26) представляет собой работу изменения объема. Следовательно, в общем случае теплота, подведенная к системе, расходуется на изменение внутренней энергии и на работу изменения объема:
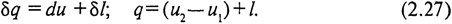
§ 11. ЭНТРОПИЯ
Так как теплоемкость в общем случае изменяется от нуля до бесконечности, определение теплоты по уравнению (2.17) возможно не для любых процессов (например, при сx = ±∞). Кроме того, теплоемкость не является параметром состояния и не дает возможности представить теплоту процесса графически. Следовательно, для общего выражения теплоты процесса необходим еще один параметр состояния.
Для вывода этого параметра рассмотрим уравнение (2.26). Поскольку δ q не является полным дифференциалом, правая часть этого уравнения du + pdv также не является полным дифференциалом. Выражения такого типа в высшей математике называют дифференциальными двучленами (так как du и dv - полные дифференциалы). В соответствии с одной из теорем высшей математики дифференциальный двучлен можно превратить в полный дифференциал некоторой новой функции, если разделить его на интегрирующий делитель. Допустив, что интегрирующим делителем для δ q является абсолютная температура Т (справедливость этого допущения будет доказана в § 27) и, обозначив новую функцию символом s, получим
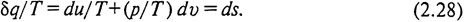
Эта функция была введена в конце XIX в. Р. Клаузиусом и названа энтропией. Поскольку ds является полным дифференциалом, энтропия является функцией (параметром) состояния, ее изменение в процессе не зависит от его пути и определяется значениями в начальном и конечном состоянии. Изменение энтропии в цикле равно нулю:
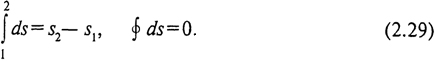
Энтропия обладает свойством аддитивности, согласно которому sm = S, S = ∑ Sj. Удельная энтропия s измеряется в Дж/(кг∙К). За начало отсчета энтропии может быть принято любое состояние вещества.
Энтропия относится к числу калорических параметров состояния и может быть представлена в зависимости от любой пары термических параметров s = (v, T); s = φ(p, T)\ s = ψ(p, v).
В соответствии с (2.28) теплоту любого обратимого процесса можно выразить через изменение энтропии

Так как абсолютная температура всегда положительна, знаки теплоты и изменения энтропии в обратимых процессах всегда одинаковы. Подвод теплоты к рабочему телу (δ q > 0) сопровожается увеличением энтропии (ds > 0), отвод теплоты (δ q < 0) - уменьшением энтропии (ds < 0).
ТЕПЛОВАЯ ДИАГРАММА
С введением энтропии общее число термических и калорических параметров состояния возросло до шести: р, v, Т, u, i, s. Все они однозначно связаны между собой термическим уравнением состояния, калорическими уравнениями состояния для внутренней энергии и для энтальпии, уравнениями связи энтропии с термическими параметрами, поэтому в качестве независимых переменных в общем случае может быть выбрана любая пара из этих параметров. Часто в качестве независимых параметров используются Т и s. Если в диаграмме Т - s нанести линию какого-либо процесса T = φ(s) (рис. 3, а), то в соответствии с геометрической интерпретацией определенного интеграла (2.30) площадь 1 d 22'1' определит теплоту этого процесса. Диаграмму T - s называют тепловой. С ее помощью легко доказать, что теплота является функцией процесса. Если между точками 1 и 2 осуществить процесс по пути 1 b 2, то площадь под линией процесса будет больше.
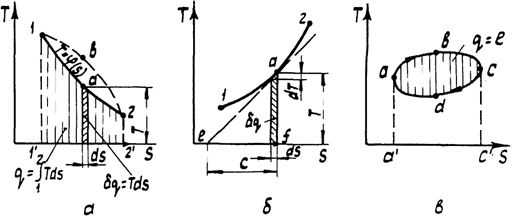
Рис. 3. Тепловая диаграмма: а - определение теплоты процесса; б - определение теплоемкости; в - определение работы цикла
Примечательным свойством тепловой диаграммы является возможность графического определения истинной теплоемкости в любой точке процесса. Для этого в заданной точке (рис. 3, б) необходимо провести касательную к линии процесса. Истинная теплоемкость в точке а определится отрезком подкасательной с на оси s. Доказательство следует из подобия двух прямоугольных треугольников с вершинами в точке а: элементарного (с катетами dT и ds) и aef (c катетами Т и с). Равенство отношений катетов dT / ds = Т / с с учетом (2.30) приводит к полученному ранее уравнению (2.16) для истинной теплоемкости
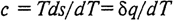
Площадь замкнутой фигуры цикла в диаграмме Т - s, как и в диаграмме p - v, определяет работу цикла (рис. 3, в). На участке abc цикла энтропия увеличивается, следовательно, теплота, эквивалентная площади abcc ' a ', подводится к рабочему телу. На участке cda теплота, эквивалентная площади adcc ' d, отводится от рабочего тела. Суммарная теплота цикла определится площадью его замкнутой фигуры abcd. Поскольку для цикла ∮ du = 0, из уравнения первого закона термодинамики (2.26) следует, что q = l = пл. abcd.