Тесты по разделу «Электрохимия»
1. Электролиз расплава хлорида натрия описывается суммарным уравнением:
1)NaCl → Na+ + Cl-
2)NaCl → Na + Cl
3)2NaCl → 2Na + Cl2
4)2NaCl + H2O → Na2О + Cl2 + H2
5)NaCl + Н2О → NaOH + Cl2 + H2
2. При электролизе водного раствора хлорида калия на инертном аноде выделяется:
1)вода
2)кислород
3)водород
4)хлор
5)гидроксид калия
3. Количественно процессы электролиза подчиняются законам
1)Ньютона
2)Ампера
3)Фарадея
4)Ома
5)Кулона
4. Процесс, протекающий при электролизе раствора сульфата натрия на платиновом аноде, описывается уравнением:
1)Na+ + 1ē →Na0
2)2H2O + 2ē → H2 + 2OH-
3)Pt - 2ē → Pt2+
4)2H2O - 4ē → 4H+ + O2
5)Na - 1ē → Na+
5. Процесс, протекающий при электролизе раствора сульфата никеля на никелевом аноде описывается уравнением:
1)2SO42- - 2 ē→ S4O82-
2)2H2O - 4 ē → O2 +4H+
3)Ni - 2 ē → Ni2+
4)2H2O +2 ē → H2 + 2OH-
5)Ni2+ + 2 ē → Ni0
6. Процесс, протекающий при электролизе раствора хлорида меди(II) на платиновом аноде, описывается уравнением
1)2Cl- -2 ē→ Cl2
2)2H2O - 4 ē → O2 + 4H+
3)Pt - 2 ē →Pt2+
4)Cu2+ + 2 ē → Cu0
5)Cu - 2 ē →Cu2+
7. При электролизе водного раствора смеси солей CuCl2, KCl, AlCl3 на катоде протекает процесс:
1)Cu2+ + 2 ē → Cu0
2)K+ + 1 ē → K
3)Al3+ + 3 ē →Al
4)2Cl- - 2 ē →Cl2
5)2H2O - 4 ē → 4H+ + O2
8. На электродах гальванического элемента Якоби-Даниэля, состоящего из цинковой и медной пластин, протекают следующие процессы:
1)A: Cu - 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn
2)A: Zn - 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
3)A: Cu - 2 ē → Cu2+ K: 2H+ + 2 ē → H2
4)A: Zn - 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)A: Zn - 2 ē → Zn2+ K: 2H+ + 2 ē → H2
9. На электродах гальванического элемента Якоби-Даниэля, состоящего из серебряной и свинцовой пластин, протекают следующие процессы:
1)A: Pb - 2 ē → Pb2+ K: Ag+ + 1 ē →Ag
2)A: Ag - 1 ē → Ag+ K: Pb2+ + 2 ē → Pb
3)A: Pb - 2 ē → Pb2+ K: 2H+ + 2 ē → H2
4)A: Pb - 2 ē → Pb2+ K: 2H2O - 4 ē →O2 + 4H+
5)A: Sn - 2 ē → Sn2+ K: Ag+ + 1 ē →Ag0
10. Гальванический элемент Вольта состоит из цинковой и медной пластин, опущенных в раствор серной кислоты. На электродах этого гальванического элемента протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
2)А: Cu – 2 ē → Cu2+ K: 2H+ + 2 ē → H2
3)А: Zn – 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
4)А: Zn – 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)А: Cu – 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn0
11. На электродах гальванического элемента Якоби-Даниэля., состоящего из цинковой и железной пластин, протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: Fe2+ + 2 ē → Fe
2)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
3)А: Fe – 2 ē → Fe2+ K: 2H+ + 2 ē → H2
4)А: Fe – 2 e → Fe2+ K: Zn2+ + 2e → Zn
5)А: Fe – 2e → Fe2+ K 2H2O + O2 +4e → 4OH-
12. Наибольшую э.д.с. имеет гальванический элемент:
1)Zn / ZnCl2, 1M // CdCl2, 1M /Cd
2)Cd / CdNO3, 1M // AgNO3, 1M / Cd
3)Zn / ZnSO4, 1M // NiSO4, 1M / Ni
4)Mg / Mg(NO3)2, 1M // AgNO3, 1M / Ag
5)Mg / MgSO4, 1M // FeSO4, 1M / Fe
13. В гальваническом элементе Якоби-Даниэля при 298 К установилось равновесие:
Zn + 2Ag+ ←→ Zn2+ + 2Ag
Концентрация ионов Zn2+ составляет 0,01моль/л, концентрация ионов Ag+ составляет 0,001 моль/л. Э.д.с. данного гальванического элемента равна:
1)1,0 В
2)-1,44 В
3)1,44 В
4)1,56 В
5)0,04 В
14. Э.д.с. гальванического элемента
Zn / ZnSO4, 0,000001 M // ZnSO4, 0,01 M /Zn равна:
1)0,76 В
2)0,06 В
3)0,12 В
4)0,24 В
5)0,18 В
15. Краткая схема гальванического элемента Якоби-Даниэля имеет вид:
Zn / ZnSO4, 1M // CuSO4, 1M / Cu
Э.д.с. данного гальванического элемента равна:
1)0,32 В
2)1,1 В
3)-1,1 В
4)-0,32 В
5)0,5 В
16. Процессы, протекающие при контактной коррозии магния и железа в нейтральной водной среде, описываются уравнениями
1)А: Mg – 2e → Mg2+ K: 2H2O + O2 – 4e → 4OH-
2)А: Mg – 2e → Mg2+ K: 2H+ + 2e → H2
3)А: Mg – 2e → Mg2+ K: Fe2+ + 2e → Fe
4)А: Fe – 2e → Fe2+ K: 2H+ + 2e → H2
5)А: Fe – 2e → Fe2+ K: 2H2O + O2 –4e → 4OH-
17.Для протекторной защиты железа от коррозии в нейтральной водной среде применяется:
1)серебро
2)цинк
3)медь
4)олово
5)свинец
18. Металлом, наиболее подверженным электрохимической коррозии при контакте с оловом, является:
1)магний
2)свинец
3)кобальт
4)железо
5)медь
19. Электрохимическая коррозия железа в нейтральной водной среде описывается уравнением:
1)4Fe + 3O2 + 6H2O = 4Fe(OH)3
2)4Fe + 3O2 = 2Fe2O3
3)Fe + 3Cl2 = 2FeCl3
4)3Fe + C = Fe3C
5)3Fe + Si + Fe3Si
20. Процессы, протекающие при коррозии оцинкованного железа во влажном воздухе, описываются уравнениями:
1)А: Zn – 2e → Zn2+
K: Fe2+ + 2e → Fe
2)А: Zn – 2e → Zn2+
K: 2H+ + 2e → H2
3)А: Zn – 2e → Zn2+
K: 2H2O + O2 – 4e → 4OH-
4)А: Fe – 2e → Fe2+
K: 2H2O + O2 –4e → 4OH-
5)А:Fe – 2e → Fe2+
K: 2H+ + 2e → H2
21. Уравнение, отвечающее электрохимической коррозии металла:
1) 2Mg + O2 = 2MgO
2) Sn + O2 = SnO2
3) 2Zn + O2 + 2H2O = 2Zn(OH)2
4) 2Pb + O2 = 2PbO
5) 4Fe + 3O2 = 2Fe2O3
22. Процесс отвода электронов с катодных участков при электрохимической коррозии называется:
1)деполяризацией
2)ионизацией
3)диссоциацией
4)аэрацией
5)катодной защитой
23. Металлом, который может служить анодным покрытием на железе, является:
1)свинец
2)олово
3)медь
4)серебро
5)магний
24. Процесс коррозии лужёного железа в кислой среде при нарушении целостности покрытия описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē → Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
4)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
5)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
25. Атмосферная коррозия лужёного железа (покрытого тонким слоем олова) описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē → Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
4)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
5)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
Тесты по разделу «Химическая связь»
1. Между атомами элементов с порядковыми номерами 3 и 9 образуется химическая связь
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
5) донорно-акцепторная
2. Наименее прочная химическая связь
1) ионная
2) водородная
3) металлическая
4) ковалентная полярная
5) ковалентная неполярная
3. При образовании молекулы хлороводорода перекрываются орбитали
1) р и d
2) р и р
3) s и р
4) s и s
5) s и d
4. При гибридизации одной одной s- и одной р-орбиталей образуются
1) две гибридные sр2-орбитали
2) одна гибридная sр-орбиталь
3) две гибридные sр-орбитали
4) одна гибридная sр2-орбитали
5) три гибридные sр-орбитали
5. Между молекулами воды образуется вид связи
1) ионный
2) водородный
3) металлический
4) донорно-акцепторный
5) ковалентная неполярный
6.Между молекулами этилового спирта образуется вид связи
1) ионный
2) водородный
3) металлический
4) донорно-акцепторный
5) ковалентная неполярный
7. Последовательность заполнения молекулярных орбиталей в порядке возрастания их энергии σs<σs*<σz<πх=πу<πх*=πу*<σz* характерна для молекулы
1) Н2O
2) НCl
3) O2
4) CO
5) ВN
8. Последовательность заполнения молекулярных орбиталей в порядке возрастания их энергии σs<σs*<πх=πу<σz <πх*=πу*<σz* характерна для молекулы
1) Н2
2) Cl2
3) O2
4) CO
5) N2
9. Кратность связи в молекуле О2 равна
1) 1
2) 2
3) 3
4) 5
5) 0
10. Кратность связи в молекуле N2 равна
1) 1
2) 2
3) 3
4) 5
5) 0
11. Кратность связи в молекуле Н2 равна
1) 1
2) 2
3) 3
4) 5
5) 0
12. В хлориде аммония отсутствуют связи
1) ионные
2) донорно-акцепторные
3) ковалентные полярные
4) ковалентные неполярные
5) водородные
13. Ковалентную неполярную связь имеет
1) Н2О
2) СО
3) Н2
4) КОН
5) Сu
14. Ковалентную полярную связь имеет
1) Cl2
2) O2
3) Н2
4) НСl
5) N2
15. Наибольшую склонность к образованию ионных связей проявляет элемент
1) N
2) Si
3) C
4) S
5) F
16. Геометрическая форма молекулы метана СН4
1) пирамидальная
2) тетраэдрическая
3) треугольная
4) угловая
5) линейная
17. Угол 109028/ образуется между гибридными
1) sр-орбиталями
2) sр2-орбиталями
3) sр3-орбиталями
4) sр3d2-орбиталями
5) sd-орбиталями
18. Угол 1200 характерен для
1) пирамидальной молекулы
2) тетраэдрической молекулы
3) треугольной молекулы
4) угловой молекулы
5) линейной молекулы
19. Угол 109028/ характерен для
1) пирамидальной молекулы
2) тетраэдрической молекулы
3) треугольной молекулы
4) угловой молекулы
5) линейной молекулы
20. Геометрическая форма молекулы аммиака NH3
1) тетраэдрическая
2) пирамидальная
3) треугольная
4) угловая
5) линейная
21. Прочность и полярность связи в ряду молекул HF→HCl→НВr→HJ изменяются:
1) как прочность, так и полярность связи увеличивается
2) прочность уменьшается, полярность увеличивается
3) как прочность, так и полярность связи уменьшаются
4) прочность увеличивается, полярность уменьшается
5) прочность и полярность связи сначала увеличивается, затем уменьшается
22. π-связь образуется при перекрывании
1) вдоль оси s-орбиталей
2) вдоль оси р-орбиталей
3) вдоль оси s-и р-орбиталей
4) р-орбиталей, оси которых параллельны
5) d-орбиталей, находящихся в двух параллельных плоскостях
23. Две π-связи имеет молекула
1) Н2О
2) СО2
3) NH3
4) O2
5) HCl
24. Двойную связь имеет молекула
1) Н2О
2) С2Н6
3) NH3
4) O2
5) HCl
25. Тройную связь имеет молекула
1) Н2О
2) СО2
3) NH3
4) C2Н2
5) HCl
26. Трехцентровую связь имеет молекула
1) Н2О
2) НNО3
3) NH3
4) O2
5) HCl
27. Линейную форму имеет молекула
1) OF2
2) ВeCl2
3) H2O
4) AlCl3
5) CH4
28. Пирамидальную форму имеет молекула
1) NH3
2) ВeCl2
3) H2O
4) AlCl3
5) CH4
29. Число σ-связей в три раза больше числа π-связей
1) хлороводородной кислоты
2) сернистой кислоты
3) ортофосфорной кислоты
4) хлористой кислоты
5) бромистоводородной кислоты
30 Все связи ковалентные неполярные в молекуле
1) СО2
2) С2Н6
3) С2Н2
4) Н2О2
5) О2
31. Парамагнитной является молекула
1) F2
2) O2
3) Cl2
4) N2
5) H2
32. В молекуле аммиака NH3 число связывающих электронных пар равно
1) 2
2) 3
3) 1
4) 0
5) 4
33. В молекуле аммиака NH3 число несвязывающих электронных пар равно
1) 2
2) 3
3) 1
4) 0
5) 4
34. Формулы соединений только с ковалентной связью представлены в ряду
1) N2, КNO3
2) КСl, CuSO4
3) H2O, СН3СООН
4) ВаСl2, КF
5) КВr, О2
Тесты по разделу «Металлы и электрохимический ряд напряжений металлов».
1. Координационное число в кристаллической решетке металлов может быть равным
1) 6 и 8
2) 8 и 10
3) 8 и 12
4) 6 и 10
2. В узлах кристаллической решетки металлов находятся
1) нейтральные атомы металла
2) положительно заряженные ионы металла
3) отрицательно заряженные ионы металла
5) отрицательно и положительно заряженные ионы металла.
3. Наибольшей электропроводностью среди металлов обладают
1) Fe, Co, Ni
2) Zn, Cu, Fe
3) Al, Cr, Mn
4) Au, Ag, Cu
4. В химических реакциях металлы выступают в роли
1) окислителей
2) восстановителей
3) окислителей и восстановителей
4) акцепторов электронов
5. Электродные потенциалы не зависят от
1) природы металла
2) концентрации соли
3) атомной массы металла
4) температуры
6. Промышленная очистка титана от примесей осуществляется
1) иодидным способым
2) электролитическим путем
3) отгонкой летучих соединений
4) зонным методом.
7. Промышленная очистка меди от примесей осуществляется
1) иодидным способом
2) электролитическим путем
3) отгонкой летучих соединений
4) зонным методом
8. Получение хрома алюмотермическим методом выражается реакцией
to
1) CrCl3 + А1 → А1С13 + Cr
(раствор) (раствор)
to
2) 2 Cr2О3 + А1 → 3Cr + CrО3 + Al2O3
to
3) Cr2О3 + 2А1 → 2Cr + Al2O3
to
4) 4 CrCl3 + 2 А12O3 → 4Cr + 4 А1С13 + 3 O2
(раствор)
9. Электролизом растворов нельзя получить
1) Na и Mg
2) Pb и Zn
3) Cu и Ag
4) Fe и Ni
10. При электрохимическом рафинировании меди, содержащей марганец, цинк, золото и серебро в анодный шлам перейдут
1) Zn и Ag
2) Mn и Au
3) Au и Ag
Zn и Mn
11. При электрохимическом рафинировании меди, содержащей марганец, цинк, железо и серебро в раствор перейдут
1) Mn u Zn
2) Mn u Ag
3) Mn, Ag u Fe
4) Mn, Zn u Fe
12. Стандартные электродные потенциалы соответствуют концентрации иона Men+, равной
1) 0,001 моль/л
2) 0,01 моль/л
3) 0,1 моль/л
4) 1 моль/л
13. Флотационный метод обогащения руды основан на
1) различии плотности минералов
2) различной смачиваемости минералов
3) различии в магнитных свойствах минералов
4) различии химических свойств минералов
14. Не взаимодействуют с разбавленной соляной кислотой
1) Zn u Mg
2) Fe u Be
3) Cu u Ag
4) Mn u Al
15. Возможным является процесс, описываемый уравнением
1) Zn + CuSO4 → ZnSO4 + Cu
2) Ag + Zn(NO3)2 → 2 AgNO3 + Zn
3) Pb + FeSO4 → PbSO4 + Fe
4) Sn + NiCl2 → SnCl2 + Ni
16. Реакция меди с концентрированной азотной кислотой описывается уравнением
1) Cu + 2 HNO3 → Cu(NO3)2 + H2↑
2) 4Cu + 10 HNO3 → 4Cu(NO3)2 + N2O↑ + 5H2O
3) 3Cu + 8 HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
4) Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2↑ + 2H2O
17. Реакция меди с разбавленной азотной кислотой описывается уравнением
1) Cu + 2 HNO3 → Cu(NO3)2 + H2↑
2) 4Cu + 10 HNO3 → 4Cu(NO3)2 + N2O↑ + 5H2O
3) 3Cu + 8 HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
4) Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2↑ + 2H2O
18. Реакция магния с разбавленной азотной кислотой выражается уравнением
1) 4Mg + 10 HNO3 → 4Mg(NO3)2 + N2O↑ + 5H2O
2) Mg + 2 HNO3 → Mg(NO3)2 + H2↑
3) Mg + 4 HNO3 → Mg(NO3)2 + 2 NO2↑ + 2H2O
4) Mg + HNO3 → MgO + HNO2
19. Концентрированная серная кислота не взаимодействует со следующими металлами
1) Cu u Ag
2) Ag u Pt
3) Zn u Mg
4) Sn u Al
20. Амфотерными свойствами обладают металлы
1) Fe u Ni
2) Be u Al
3) Na u Mg
4) Co u K
21. Не взаимодействуют с водой
1) Mg u K
2) Mn u Na
3) Ca u Ba
4) Zn u Sn
22. Относятся к легким конструкционным следующие металлы
1) Mg u Al
2) Co u Ni
3) Ti u Pt
4) Cu u Zn
23. Из четырех металлов Li, Na, K, Rb наименьший потенциал ионизации имеет
1) Li
2) Na
3) K
4) Rb
24. Из четырех металлов Mg, Ca, Sr, Ba наименьшую электроотрицательность имеет
1) Mg
2) Ca
3) Sr
4) Ba
25. Разбавленная серная кислота не взаимодействует со следующими металлами
1) Сu u Hg
2) Al u Fe
3) Zn u Cr
4) Mg u Pb
Тесты по разделу «Строение атома и периодическая система Д.И.Менделеева».
1.Ядерную планетарную модель атома предложил
1) Бор
2) Зоммерфельд
3) Резерфорд
4) Планк
5) Томсон
2.Принцип неопределенности Гейзенберга описывается уравнением
1) 
2) 
3)  q
q  V
V  h/m
h/m 
4) 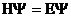
5) E = mc2
3.Уравнение Де-Бройля имеет вид
1)  =h/mv
=h/mv
2) 
3) 
4) 
5) E = mc2
4. Уравнение Шредингера имеет вид
1) 
2) 
3) 
4) H  =E
=E 
5) E = mc2
5. Изотопами являются
1) 40Ca и 42Ca
20 20
2) 40Ar и 40K
18 19
3) 40Ca и 40K
20 19
4) 136Xe и 138Ba
54 56
5) 23Na и 39K
11 19
6. Ядро атома состоит из
1) протонов и электронов
2) протонов и нейтронов
3) нейтронов и электронов
4) протонов
5) протонов, нейтронов и электронов
7. Энергию и размер орбитали характеризует
1) главное квантовое число n
2) орбитальное квантовое число l
3) магнитное квантовое число ml
4) спиновое квантовое число ms
5) количество находящихся на ней электронов

8. Форму атомной орбитали определяет
1) главное квантовое число n
2) орбитальное квантовое число l
3) магнитное квантовое число ml
4) спиновое квантовое число ms
5) порядковый номер атома в таблице Менделеева
9. Магнитное квантовое число ml характеризует
1) энергию орбитали
2) размер орбитали
3) форму орбитали
4) собственный механический момент движения электрона
5) ориентацию орбитали в пространстве
10. Все возможные значения магнитного квантового числа для d-орбиталей
1) 1,2,3
2) –1,0,1
3) –2,-1,0,1,2,3
4) –3,-2,-1,0,1,2,3
5) 1,2,3,4
11. Все возможные значения магнитного квантового числа для p-орбиталей
1) 1,2,3
2) –1,0,1
3) –2,-1,0,1,2
4) –3,-2,-1,0,1,2,3
5) 1,2,3,4
12. Какие орбитали имеют форму гантели
1) s-орбитали
2) p-орбитали
3) d-орбитали
4) f-орбитали
5) гибридные орбитали
13. В атоме не может быть …… электронов с одинаковым набором четырех квантовых чисел
1) двух
2) трех
3) пяти
4) семи
5) четырех
14. Какое электронное состояние возможно
1) 2s3
2) 3p7
3) 4d11
4) 3f 5
5) 5d 6

|




 15. Строение внешней электронной оболочки в устойчивом состоянии имеет
15. Строение внешней электронной оболочки в устойчивом состоянии имеет
|
1) кислород
2) кремний
3) азот
4) алюминий
5) фтор
16. В невозбужденном состоянии число электронов на четвертом энергетическом уровне равно пяти у
1) технеция
2) брома
3) германия
4) мышьяка
5) ванадия
17. Способность атомов притягивать к себе электронную плотность
1) потенциал ионизации
2) электроотрицательность
3) сродство атома к электрону
4) электростатическое притяжение
5) электрохимический потенциал
18. Энергия, выделяющаяся при присоединении электрона к свободному атому
1) потенциал ионизации
2) электроотрицательность
3) сродство атома к электрону
4) электростатическое притяжение
5) энергия Гиббса
19. Величина I в процессе


 A(атом) + I A+ + 1 e
A(атом) + I A+ + 1 e
1) потенциал ионизации
2) электроотрицательность
3) сродство атома к электрону
4) внутренняя энергия
5) стандартный электродный потенциал
20. Количество протонов, нейтронов и электронов в атоме 52Cr
1) 52,24,52 24
2) 24,52,24
3) 24,24,28
4) 28,24,24
5) 24,28,24
21. В атоме 127J …. нейтронов
53
1) 53
2) 127
3) 180
4) 74
5) 85
22. Электроотрицательность элементов в таблице Д.И. Менделеева в периодах слева направо …., а в группах сверху вниз ….
1) уменьшается, уменьшается
2) увеличивается, уменьшается
3) увеличивается, увеличивается
4) уменьшается, увеличивается
5) увеличивается, не изменяется
23. В атоме 51V …. протонов
23
1) 23
2) 51
3) 74
4) 28
5) 25
24. Возможные валентности серы с точки зрения строения атома
1) 3, 5
2) 2, 4, 6
3) 1, 3, 5
4) 5, 7
5) 1, 3
25. Возможные валентности хлора с точки зрения строения атома
1) 1,7
2) 1,5,7
3) 1,3,5,7
4) 1,2,7
5) 1,2,4,7