Виды колебаний
- По физической природе
- Механические (звук, вибрация)
- Электромагнитные (свет, радиоволны, тепловые)
- Смешанного типа — комбинации вышеперечисленных
Характеристики
· Амплитуда — максимальное отклонение колеблющейся величины от некоторого усреднённого её значения для системы, 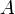 (м)
(м)
· Период — промежуток времени, через который повторяются какие-либо показатели состояния системы (система совершает одно полное колебание), 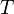 (сек)
(сек)
· Частота — число колебаний в единицу времени, 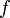 (Гц, сек−1).
(Гц, сек−1).
· Период колебаний и частота — обратные величины;
 и
и 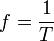
В круговых или циклических процессах вместо характеристики «частота» используется понятие круговая (циклическая) частота 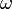 (рад/сек, Гц, сек−1), показывающая число колебаний за 2π единиц времени:
(рад/сек, Гц, сек−1), показывающая число колебаний за 2π единиц времени:
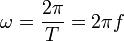
· Смещение — отклонение тела от положения равновесия. Обозначение Х, Единица измерения метр.
· Фаза колебаний — определяет смещение в любой момент времени, то есть определяет состояние колебательной системы.
Гармоническое колебание — явление периодического изменения какой-либо величины, при котором зависимость от аргумента имеет характер функции синуса или косинуса. Например, гармонически колеблется величина, изменяющаяся во времени следующим образом:
x(t) = Asin(ωt + φ)
или
x(t) = Acos(ωt + φ),
Графики функций f(x) = sin(x) и g(x) = cos(x) на декартовой плоскости.
где х — значение изменяющейся величины, t — время, остальные параметры - постоянные: А — амплитуда колебаний, ω — циклическая частота колебаний, (ωt + φ) — полная фаза колебаний,  — начальная фаза колебаний.
— начальная фаза колебаний.
Обобщенное гармоническое колебание в дифференциальном виде

Виды колебаний
Свободные колебания совершаются под действием внутренних сил системы после того, как система была выведена из положения равновесия. Чтобы свободные колебания были гармоническими, необходимо, чтобы колебательная система была линейной (описывалась линейными уравнениями движения), и в ней отсутствовала диссипация энергии (последняя вызвала бы затухание).
Вынужденные колебания совершаются под воздействием внешней периодической силы. Чтобы они были гармоническими, достаточно чтобы колебательная система была линейной (описывалась линейными уравнениями движения), а внешняя сила сама менялась со временем как гармоническое колебание (т.е. чтобы зависимость от времени этой силы была синусоидальной).




Вопрос 11 Идеальный газ. Давление газа. Основное уравнение МКТ идеального газа.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
- объём частицы газа равен нулю (то есть, диаметр молекулы
 пренебрежимо мал по сравнению со средним расстоянием между ними,
пренебрежимо мал по сравнению со средним расстоянием между ними, 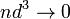 ) [1];
) [1]; - импульс передается только при соударениях (то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях);
- суммарная энергия частиц газа постоянна (то есть, нет передачи энергии за счет передачи тепла или излучения)
Давле́ние (P) — физическая величина, равная силе F, действующей на единицу площади поверхности S перпендикулярно этой поверхности. В данной точке давление определяется как отношение нормальной составляющей силы Fn, действующей на малый элемент поверхности, к его площади:
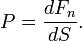
Среднее давление по всей поверхности есть отношение силы к площади поверхности:
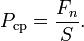
Давление характеризует состояние сплошной среды и является диагональной компонентой тензора напряжений. В простейшем случае изотропной равновесной неподвижной среды давление не зависит от ориентации. Давление можно считать также мерой запасённой в сплошной среде потенциальной энергии на единицу объёма и измерять в единицах энергии, отнесённых к единице объёма.
Вопрос 12 Уравнение состояния идеального газа (уравнение Менделеева- Клапейрона). Законы идеальных газов. Изопроцессы.
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа. Свойства идеального газа описываются уравнением Менделеева — Клапейрона

где 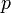 — давление,
— давление,  — концентрация частиц,
— концентрация частиц,  — постоянная Больцмана,
— постоянная Больцмана,  — абсолютная температура.
— абсолютная температура.
Для любого идеального газа справедливо соотношение Майера: 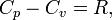
где  — универсальная газовая постоянная,
— универсальная газовая постоянная,  — молярная теплоемкость при постоянном давлении,
— молярная теплоемкость при постоянном давлении, 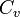 — молярная теплоемкость при постоянном объёме.
— молярная теплоемкость при постоянном объёме.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
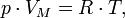
В случае постоянной массы газа уравнение можно записать в виде: 
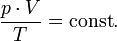
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
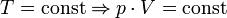 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
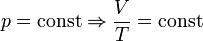 — Закон Гей-Люссака
— Закон Гей-Люссака  — закон Шарля (второй закон Гей-Люссака, 1808 г.)
— закон Шарля (второй закон Гей-Люссака, 1808 г.)
Законы идеальных газов
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
1. Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
2. Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
3. Изотермический процесс. Закон Бойля – Мариотта. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: T = const.
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Уравнение изотермы: 
4. Адиабатический процесс (изоэнтропийный):
Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
5. Политропический процесс.
Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA=6,02·1023молекул (число Авогадро).
7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:
Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
При 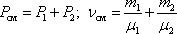 , давление смеси газов:
, давление смеси газов: 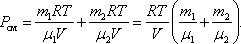
Объединённый газовый закон (Закон Клапейрона).
В соответствии с законами Бойля – Мариотта и Гей-Люссака можно сделать заключение, что для данной массы газа 
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс). Линии, изображающие данные процессы на какой-либо термодинамической диаграмме, называются изобара, изохора, изотерма и адиабата соответственно. Изопроцессы являются частными случаями политропного процесса.
- Изобарный процесс (др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — процесс изменения состояния термодинамической системы при постоянном давлении (P = const)
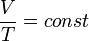
- Изохорный процесс (от греч. хора — занимаемое место) — процесс изменения состояния термодинамической системы при постоянном обьеме (V = const). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объеме, давление прямо пропорционально температуре:
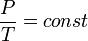
- Изотермический процесс (от греч. «термос» — тёплый, горячий) — процесс изменения состояния термодинамической системы при постоянной температуре (T = const)(PV = const). Изотермический процесс описывается законом Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
- Изоэнтропийный процесс — процесс изменения состояния термодинамической системы при постоянной энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
pVγ = const
где γ — показатель адиабаты, определяемый типом газа.
Вопрос13 Внутренняя энергия и способы ее измерения. Количество теплоты, выделяющееся при сгорании топлива.
ВНУТРЕННЯЯ ЭНЕРГИЯ
Все тела состоят из молекул, которые непрерывно движутся и взаимодействуют друг с другом.
Они обладают одновременно кинетической и потенциальной энергией.
Эти энергии и составляют внутреннюю энергию тела.
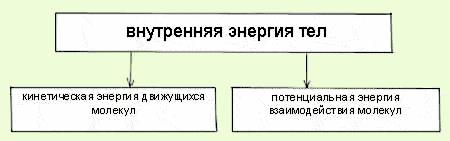
Таким образом, внутренняя энергия - это энергия движения и взаимодействия частиц,
из которых состоит тело.
Внутренняя энергия характеризует тепловое состояние тела.