Гальванический элемент
Гальванический элемент представляет собой систему, в которой окислительно-восстановительный процесс приводит к превращению химической энергии в электрическую за счет пространственного разделения процессов окисления и восстановления.
Гальванические элементы используются в качестве химических источников постоянного тока и для определения стандартных электродных потенциалов.
Если два металла погрузить в растворы их солей, то возникнут соответствующие электродные потенциалы. При соединении металлов внешним проводником, а электролитов – электролитическим ключом или пористой перегородкой, возникает электрический ток в цепи за счет разности величин электродных потенциалов этих металлов. Чем больше различаются электродные потенциалы металлов, тем больше эта разность или электродвижущая сила (ЭДС) гальванического элемента.
Катод - электрод, на котором протекает процесс восстановления.
Анод -электрод, на котором протекает процесс окисления.
Потенциал катода больше потенциала анода.
Например, при погружении кадмиевой и никелевой пластинок в растворы их сульфатных солей с концентрацией (активностью) 1 моль/л на границе раздела фаз металл – раствор устанавливается равновесие:
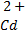 + 2ē ↔Cd
+ 2ē ↔Cd 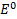 = -0,4 В;
= -0,4 В;
 + 2ē ↔Ni
+ 2ē ↔Ni  = -0,25 В.
= -0,25 В.
Из величин электродных потенциалов металлов следует, что у кадмия способность посылать ионы в раствор больше, чем у никеля, поэтому и количество свободных электронов на кадмиевом электроде будет больше при прочих равных условиях.
Если составить никелево-кадмиевый гальванический элемент, электроны с кадмия будут переходить на никель, такой переход нарушит равновесие в системах на границе металл – раствор, на кадмии произойдет смещение равновесия влево, он будет окисляться, на никеле – вправо, ионы никеля будут восстанавливаться. Кадмий будет анодом, а никель – катодом.
Каждый гальванический элемент можно изобразить в виде схемы:
анод – Cd | CdSO4 || NiSO4 | Ni + катод
Одна вертикальная черта обозначает поверхность раздела между электродом и раствором, двойная черта – раздел между растворами.
Анодный процесс: Cd - 2ē = Cd2+ окисление.
Катодный процесс: Ni2+ + 2ē = Ni восстановление.
Суммарное уравнение токообразующей реакции:
Cd + Ni2+ = Cd2+ + Ni;
Cd + NiSO4 = CdSO4 + Ni.
Используя величины электродных потенциалов металлов, можно определить направление тока в гальваническом элементе и вычислить электродвижущую силу элемента (ЭДС). Во внешней цепи электроны перемещаются от анода катоду. Для вычисления ЭДС (ΔЕ) находят разность между величинами потенциалов катода и анода.
ΔЕ = Е катода - Е анода = -0,25 - (-0,4) = 0,15 В.
Максимальная электрическая работа гальванического элемента Amax равна изменению энергии Гиббса и представляет собой произведение числа молей перенесенных электронов n, постоянной Фарадея F (количества электричества в 1 моле электронов, выраженное в Кл и равное 96500) и электродвижущей силы процесса ΔE:
-ΔG = Amax = n·F·ΔE.
Как и при любых других самопроизвольных процессах, реакция, протекающая в гальваническом элементе, сопровождается уменьшением энергии Гиббса (ΔG < 0) при условии, что ΔE > 0. Но это означает, что при непосредственном взаимодействии реагирующих веществ реакция будет протекать в том же направлении.
Таким образом, условием самопроизвольного протекания окислительно-восстановительной реакции будет положительная разность потенциалов окислителя (катода) и восстановителя (анода):
ΔЕ = Е (Ox) - Е (Red) > 0.
Так как, ΔG0 связана с константой равновесия К реакции уравнением:
-ΔG0 = R·T·lnK = 2,3·R·T·lgK, где Т – абсолютная температура, то
n·F·ΔE0 = 2,3·R·T·lgK.
Пользуясь этим соотношением, можно по экспериментально определенному значению стандартной ЭДС вычислить константу равновесия соответствующей окислительно-восстановительной реакции.
Для 25°С (298 К) последнее уравнение после подстановки в него значений R (8,31 Дж/моль·К) и F (96500 Кл/моль) преобразуется к виду:
lgK = n·ΔE0/0,059.
Чем больше константа равновесия К,, тем более полно протекает реакция при температуре Т (выход продуктов реакции больше или степень превращения веществ выше).
Например, константа равновесия реакции, протекающей в кадмиево-никелевом гальваническом элементе, будет равна:
lgK = 2·0,15/0,059 = 5,08;
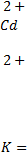
Это означает, что в состоянии равновесия концентрация ионов кадмия в растворе будет в 120226 раз больше, чем концентрация ионов никеля. При данном соотношении концентраций потенциалы обоих электродов будут одинаковы, а ЭДС будет равна нулю, т.е. произойдет полный разряд гальванического элемента.
Уравнение Нернста
Немецкий химик В. Г. Нернст предложил уравнение (уравнение Нернста), которое отражает зависимость окислительно–восстановительного потенциала системы Ox + nē ↔ Red от температуры и активности окисленной и восстановленной форм вещества в растворе:
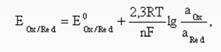
где E(Ox/Red)- равновесный окислительно–восстановительный потенциал системы при любой активности окисленной и восстановленной форм вещества;
E0(Ox/Red) - стандартный окислительно–восстановительный потенциал системы, В;
R – газовая постоянная, равная 8,31 Дж/моль·К;
F – постоянная Фарадея, 96500 Кл/моль;
Т – абсолютная температура, К;
п - число молей электронов, принимаемых окисленной формой при превращении ее в восстановительную;
аОх и аRed – активности окисленной и восстановленной форм вещества.
Для температуры 25°С (298 К) после подстановки численных значений R, F и Т уравнение Нернста приобретает вид:
 .
.
В металлических электродных системах Mn+/M, участвующие в реакции металлы являются твердыми практически чистыми индивидуальными веществами, поэтому их активность постоянна и равна единице (aRed = 1). В связи с этим уравнение Нернста упрощается:
. 
Если парциальное давление водорода сохраняется постоянным и равно 101,3 кПа, а температура 298 К, то уравнение Нернста для расчета потенциала водородного электрода имеет вид: 
В частности в нейтральных растворах (рН=7):

Аналогично водородному электроду можно создать кислородный электрод. Для этого металлическую пластину необходимо привести в контакт с кислородом и раствором, содержащим гидроксид-ионы. Схема электрода: O2, Pt |OH-..
Равновесие на кислородном электроде выражает уравнение:
О2 + 2Н2О + 4ē ↔ 4ОН-..
Если парциальное давление кислорода равно 101,3 кПа, активность воды считаем величиной постоянной, поскольку она в ходе реакции меняется мало, то получаем для 298 К:

Таким образом, можно вычислить равновесный потенциал любого электрода и охарактеризовать окислительно-восстановительные свойства, составляющих его веществ.
Пример 1. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Учитывая, что активность является эффективной концентрацией и связана с концентрацией (С) уравнением a = fC, где f – коэффициент активности, для разбавленных растворов f → 1 и активность примерно равна молярной концентрации, которая обозначается [Ox], [Red], запишем уравнение Нернста для магниевого электрода Mg2+/Mg:

Выражая из уравнения lg[Mg2+] и подставляя численные значения  = −2,41 В,
= −2,41 В,  = −2,36 В и n = 2, получаем:
= −2,36 В и n = 2, получаем:
lg[Mg2+] =-1.695
[Mg2+] = 10-1,695 = 0,02 моль/л.
Пример 2. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 272 мВ. Чему равен рН раствора, в который погружен анод, если катод погружен в раствор с рН=3? Написать уравнения электродных реакций.
Концентрационный гальванический элемент - гальванический элемент, составленный из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией.
Составим схему гальванического элемента:
− H2, Pt | H+(а) || H+(к) | Pt, H2 +
рН(а) -? рН(к)=3.
Анодный процесс: Н2 – 2ē = 2Н+(а) Еа = −0,059·рН(а).
Катодный процесс: 2Н+(к) + 2ē = Н2 Ек = −0,059·3 = − 0,177 В.
Уравнение токообразующей реакции: Н+(к) → Н+(а).
Ионы водорода из раствора у анода переносятся в раствор у катода.
ЭДС гальванического элемента равна разности потенциалов, составляющих его электродов:
ΔЕ = Ек – Еа = 0,272 В.
Еа = Ек – ΔЕ = − 0,177 – 0,272 = − 0,449 В
рНа = − Еа/0,059 = 0,449/0,059 = 7,6
Электролиз
Общие понятия об электролизе. Законы Фарадея
Если систему, состоящую из двух электродов и раствора электролита, включить в цепь постоянного электрического тока, то у электродов начинают протекать окислительно-восстановительные реакции.
Источник постоянного тока передаёт электроны от одного электрода (анода) к другому электроду (катоду) Поэтому анод имеет положительный заряд, а катод - отрицательный. Находящиеся в растворе электролита положительные ионы-катионы, например ионы меди, постепенно притягиваются к катоду, получают от него электроны и восстанавливаются. Отрицательно заряженные ионы-анионы, например ионы хлора, притягиваются к аноду и отдают ему электроны, т.е. окисляются.
Электролиз - совокупность окислительно-восстановительных процессов, происходящих при прохождении постоянного электрического тока через расплав или через раствор электролита.
При электролизе происходит превращение электрической энергии в химическую. Этот процесс является несамопроизвольным.
На катоде происходит процесс присоединения электронов окислителем (восстановление).
На аноде происходит процесс отдачи электронов восстановителем (окисление).
Химические реакции, протекающие при электролизе, зависят от природы электролита, растворителя и материала электродов.
В 1833 г. английский ученый М. Фарадей открыл законы, определяющие зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химические превращения на электроде. С учетом современной терминологии законы Фарадея можно записать в следующем виде:
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Законы Фарадея можно записать в виде общей формулы:  ,
,
где m – масса вещества, окисленного или восстановленного на электроде, г;
Мэ – молярная масса эквивалента вещества, г/моль;
I – сила тока, А;
τ – время проведения электролиза, с;
F – постоянная Фарадея (96500 Кл/моль).