Основные понятия, законы, формулы.
Относительно молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома) m  данного вещества к
данного вещества к  массы атома углерода m
массы атома углерода m  :
:
Мr = 
Основное уравнение молекулярно-кинетической теории.
p  p
p 
РV=(m/M)RT – уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
p – давление идеального газа,
V –его объем,
m – масса газа,
М – молярная масса,
R=8,31 (Дж/моль*К) – молярная газовая постоянная,
Т – абсолютная температура газа.
Р1V1|T1=Р2V2|T2 - объединенный газовый закон
ρ= m/V – плотность газа.
Уравнение состояния идеального газа можно записать так:
Р=(m/V)(RT/M) или Р= ρ (RT/M).
p=knT - связь между давлением идеального газа, его концентрацией и абсолютной температурой.
закон Дальтона: давление смеси газов равно сумме парциальных давлений каждого газа в отдельности (парциальным давлением называют давление каждого газа, входящего в смесь газов): р=р1 +р2 + р3+…+рn.
T=t+273 – термодинамическая температура.
сренеквадратичная скорость молекулы газа:

C помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех макроскопических параметров остаются неизменными. Количественные зависимости между двумя параметрами при фиксированном значении третьего параметра называют газовыми законами. Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.
Изотермический процесс - процесс изменения состояния термодинамической системы (газ) макроскопических тел при постоянной температуре называют изотермическим.
В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Бойля-Мариотта. Для газа данноймассы произведение давления газа на его объём постоянно, если температура газа не меняется. Математическая запись закона выглядит так:



Зависимость макроскопических параметров в различных осях выглядит следующим образом:
Легко заметить, что изотерме располагающейся выше в осях P,V соответствует большая абсолютная температура.
Изобарный процесс - процесс изменения состояния термодинамической системы (газ) при постоянном давлении называют изобарным.
В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Гей-Люссака. Для газа данной массы отношение объёма к температуре постоянно, если давление газа не меняется. Математическая запись закона выглядит так:
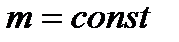 ,
, 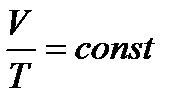 ,
, 
Зависимость макроскопических параметров в различных осях выглядит следующим образом:
Нетрудно определить, что изобаре в осях V,T имеющей меньший угол наклона к оси температур соответствует большее давление.
Изохорный процесс - процесс изменения состояния термодинамической системы (газ) при постоянном объёме называют изохорным.
В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Шарля. Для газа данной массы отношение давления к температуре постоянно, если объём газа не меняется. Математическая запись закона выглядит так: 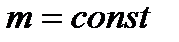 ,
,  ,
, 
Зависимость макроскопических параметров в различных осях выглядит следующим образом:
Нетрудно определить, что изохоре в осях P,T имеющей меньший угол наклона к оси температур соответствует больший объём.