Поверхностные явления проявляются в гетерогенных системах, т.е. системах, между компонентами которых имеется поверхность раздела.
Поверхностными явлениями называют процессы, происходящие на границе раздела фаз и их причиной служит особое энергетическое состояние частиц (атомов, молекул, ионов) поверхностного слоя.
Все поверхности раздела в зависимости от агрегатного состояния граничащих фаз делят на 2 типа:
1. Подвижные поверхности раздела: между жидкостью и газом (Ж-Г) и двумя несмешивающимися жидкостями (Ж-Ж).
2. Неподвижные поверхности раздела: между твердым телом и газом (Т-Г), твердым телом и жидкостью (Т-Ж).
Поверхностная энергия, отнесенная к единице площади поверхности, называется поверхностным натяжением.
σ – поверхностное натяжение, Дж/м2 или Н/м
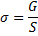
G – поверхностная энергия Гиббса,
S – площадь поверхности
Поверхностное натяжение зависит:
1. Природы жидкости;
2. Температуры; σ ↓, Т↑
3. Давления; σ ↓, Р↑
4. Природы и концентрации растворенных веществ (могут ↓, ↑ и не влиять).
Поверхностная активность – это способность растворенных веществ изменять поверхностное натяжение растворителя.
g – поверхностная активность, (Дж ·м)/моль или (Н·м2)
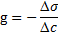
Δσ – изменение поверхностного натяжения, σ раствора – σ растворителя
Δс – изменение концентрации, с раствора – с растворителя
1. Вещества, понижающие поверхностное натяжение называют поверхностно-активными (ПАВ). По отношению к водным растворам ПАВ являются спирты, жирные кислоты и их соли, амины и другие вещества, имеющие дифильное строение молекул, т.е. полярную часть (функциональные группы) и неполярную часть (углеводородный радикал).
Поверхностно-активными по отношению к воде являются вещества менее полярные, чем вода. Они взаимодействуют с водой слабее, чем молекулы воды между собой, значит, попадая на поверхность, они уменьшают поверхностное натяжение.
Поверхностно-активные вещества (ПАВ): спирты; карбоновые кислоты; сложные эфиры; амины
g<0, ↓ σ
2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К ним относятся сильные электролиты: соли, кислоты, щёлочи. Ионы, образующиеся в результате диссоциации, взаимодействуют с водой сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды в объём раствора. Однако немногие оставшиеся на поверхности ионы создают вблизи поверхности силовое поле, тем самым повышая поверностное натяжение.
Поверхностно-инактивные вещества (ПИВ): неорганические кислоты; соли; основания; аминоуксусная кислота (глицин).
g>0, ↑σ
3. Существуют вещества, растворение которых практически не приводит к изменению поверностного натяжения. Такие вещества являются поверхностно-неактивными. К ним относятся вещества, имеющие много полярных групп, например, сахароза.
Поверхностно-неактивные вещества (ПНВ): сахароза
g =0
Адсорбция – самопроизвольное изменение концентрации растворенного вещества на границе раздела фаз.
АДСОРБЕНТОМ называется вещество, на котором адсорбируются молекулы других веществ;
АДСОРБТИВОМ называется вещество, молекулы которого адсорбируются на адсорбенте.
ХИМИЧЕСКАЯ АДСОРБЦИЯ (хемосорбция) осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической связи. Энергия возникающих при этом связей 40 – 400 кДж/моль.
Хемсорбция практически необратима, специфична и локализована. Повышение температуры усиливает адсорбцию.
ФИЗИЧЕСКАЯ АДСОРБЦИЯ обусловлена межмолекулярным взаимодействием за счёт сил Ван-дер-Ваальса (ориентационных, индукционных и дисперсионных) или водородной связью. Поэтому для этого вида адсорбции характерны: обратимость, неспецефичность, экзотермичность.
Дж. Гиббс на основе второго закона термодинамики в 70-х гг. XIX в. вывел важное уравнение, связывающее величину адсорбции со способностью растворённого вещества изменять поверхностное натяжение раствора:
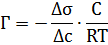
Г – адсорбция, моль/м2;
С – равновесная концентрация растворенного вещества, моль/дм3;
R – универсальная газовая постоянная, 8,314 Дж/моль∙К;
Т – температура, К;
Δσ – изменение поверхностного натяжения, σ раствора – σ растворителя
Δс – изменение концентрации, с раствора – с растворителя
Уравнение Гиббса отражает следующую зависимость: чем сильнее уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше его поверхностная активность.
Это свидетельствует о том, что знак «минус» указывает на обратную зависимость между величиной адсорбции Г и поверхностным натяжением σ.
Если 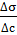 < 0, то Г > 0, т.е. адсорбция положительна (вещество накапливается на поверхности раздела фаз), это характерно для ПАВ. Если же
< 0, то Г > 0, т.е. адсорбция положительна (вещество накапливается на поверхности раздела фаз), это характерно для ПАВ. Если же 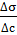 > 0, то Г < 0, т.е. адсорбция отрицательна (вещество накапливается в объёме), это характерно для ПИВ.
> 0, то Г < 0, т.е. адсорбция отрицательна (вещество накапливается в объёме), это характерно для ПИВ.
Адсорбция зависит:
1. Природы адсорбента;
2. Природы адсорбата;
3. Температуры; ↑ Т, адсорбция ↓
4. Давления. ↑ Р (для газов), адсорбция ↑
Адсорбция газов и паров адсорбата на твёрдых адсорбентах – процесс, протекающий за счёт сил Ван-дер-Ваальса и водородных связей. Количество поглощённого газа или пара зависит от следующих факторов.
1. От свободной поверхностной энергии адсорбента. Она весьма велика у адсорбентов с аморфной структурой (активированный уголь) и у кристаллических веществ (оксиды алюминия, кремния). Адсорбент тем эффективнее, чем мельче измельчен.
2. От сродства адсорбтива к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные на неполярных. Чем больше адсорбент склонен к межмолекулярным взаимодействиям, тем интенсивнее идет адсорбция.
3. При физической адсорбции из смеси газов или паров лучше адсорбируется тот компонент, который легче сжимается, поскольку его молекулы более склонны к межмолекулярным взаимодействиям.
4. От концентрации адсорбата. Зависимость имеет сложный характер, так как с адсорбцией идет одновременно процесс десорбции. При равенстве скоростей этих процессов наступает равновесие.
В 1915 г Ленгмюр ввел понятие о-б ориентации молекул ПАВ в поверхностном слое.
Ленгмюр сформулировал принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа молекулы, обладающая большим сродством к полярной фазе, втягивается в воду, в то время как неполярный радикал выталкивается в неполярную фазу. Происходящее при этом уменьшение свободной поверхностной энергии ограничивает размеры поверхностного слоя толщиной в одну молекулу. Образуется мономолекулярный слой.
При малых концентрациях ПАВ углеводородные радикалы «лежат» на поверхности полярной жидкости, а полярные группировки погружены в неё. Затем по мере роста концентрации ПАВ, они (неполярные радикалы) начинают подниматься. В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом Ленгмюра» из вертикально ориентированных молекул ПАВ. Значение поверхностного натяжения в этом случае приближается к значению, характерному для чистого ПАВ на границе с воздухом.
Изучая адсорбцию на твердых поверхностях Ленгмюр предложил теорию мономолекулярной адсорбции и уравнение адсорбции. Основные положения теории Ленгмюра следующие:
ü адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах, где имеются участки с наиболее нескомпенсированными силовыми полями;
ü каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что приводит к образованию мономолекулярного слоя поглощаемого вещества;
ü процесс адсорбции обратим и носит динамический характер, т.к. адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция такого же числа новых молекул.
Исходя из этих положений, Ленгмюр предложил уравнение адсорбции:
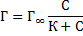
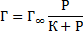
Г – адсорбция, моль/м2;
Г∞ – предельная адсорбция, моль/м2;
С – равновесная концентрация вещества, моль/дм3;
Р – равновесное давление вещества, КПа
К – константа адсорбционного равновесия