Пептидная связь – это связь между альфа-карбоксильной группой одной аминокислоты и альфа-аминогруппой другой аминокислоты.
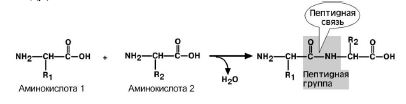
Рис 5. Образование пептидной связи
К свойствам пептидной связи относятся:
1. Трансположение заместителей (радикалов) аминокислот по отношению к C-N связи. Рис 6.
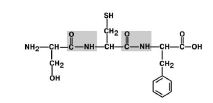
Рис 6. Радикалы аминокислот находятся в транс-положении.
2. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи. Рис 7, а.
3. Наличие кето формы и енол ьной формы. Рис 7, б 
Рис 7. а) б)
4. Способность к образованию двух водородных связей с другими пептидными группами. Рис 8.
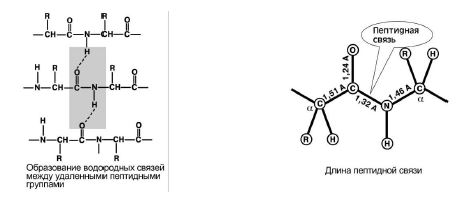
Рис 8.
5. Пептидная связь имеет частично характер двойной связи. Ее длина меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено.
Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию(пространственное расположение атомов). [5]
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, а также различные свойства и функции.
Большинство белков имеют вид спирали в результате образования водородных связей между —CO- и —NH- группами разных аминокислотных остатков полипептидной цепи. Водородные связи непрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль — вторичная структура белка.
Третичная структура — трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация — глобула. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка, в данном случае основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия.
Такая сложность структуры белковых молекул связана с разнообразием функций, которые свойственны этим биополимерам, например, защитная, структурная и т.д.
Нарушение природной структуры белка называют денатурацией. Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остается в виде полипептидной цепи, то есть в виде первичной структуры.
Этот процесс частично обратим: если не нарушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенность строение макромолекулы белка определяются его первичной структурой. [6]
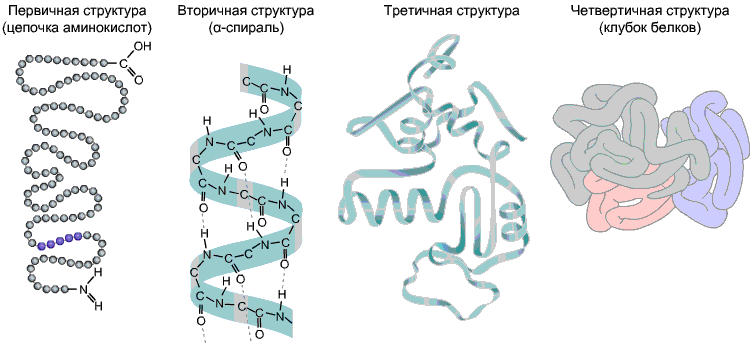
Рис 9. Белковые структуры