Текст задания: Выполните тест. В каждом номере выберите одно правильное утверждение.
Вариант:
1. Число протонов, которые содержатся в атоме кислорода равно:
1) 6; 2) 12; 3) 8.
2. Формула высшего оксида элемента, электронная формула которого 1s 22s22p 63s 23p3 : 1)N2 O5 ; 2) P2 O5; 3) B2O3 .
3. Наиболее ярко выраженные неметаллические свойства проявляет:
1) фосфор; 2) сера; 3) кремний.
4. Формула вещества с ковалентной полярной связью:
1) H2O; 2) O2; 3) CaCl2
5. Формула основания и кислоты соответственно:
1) Ca(OH)2 и Be(OH)2 ;
2) NaOH и KHSO4;
3) Al(OH)3 и HNO3
6. Формула сульфита натрия:
1) Na2SO4; 2) Na2SO3; 3) Na2S
7. К реакциям замещения относится:
1) Ca + H2SO4 à CaSO4 + H2;
2) Сu(OH)2 à CuO + H2O;
3) KOH + HNO3 à KNO3 + H2O
8. Электролиты, при диссоциации которых образуются катионы металла и гидроксид-ионы называются:
1) солями; 2) кислотами; 3) основаниями.
9. Вода образуется при взаимодействии в растворе соляной кислоты и: 1) гидроксида кальция; 2) кальция; 3) силиката кальция.
10. Присутствие в растворе щелочи можно доказать с помощью: 1) лакмуса; 2) фенолфталеина; 3) кислоты.
Условия выполнения заданий:
Место проведения: учебный кабинет
Время выполнения задания 20 мин.
Задание № 2 (практическое)
Текст задания: Назовите согласно международной или тривиальной номенклатуре следующие соединения, определите к какому классу они относятся, дайте определения этих классов веществ:
Вариант:
Li2CO3, Fe2O3
Условия выполнения заданий:
Место проведения: учебный кабинет
Время выполнения задания: 10 мин.
Оборудование: вы можете воспользоваться периодической таблицей химических элементов Д.И.Менделеева
Задание № 3 (практическое)
Текст задания: Решите задачу по составлению уравнения реакции
Вариант: молекулярное и ионное
BaCl2+K2SO4=
Условия выполнения заданий:
Место проведения: учебный кабинет
Время выполнения задания 10 мин.
Преподаватель Прядко О.Ф.
Министерство образования, науки и молодежной политики Краснодарского края
Государственное бюджетное профессиональное образовательное учреждение
Краснодарского края «Колледж Ейский»
| Рассмотрено и одобрено предметной (цикловой) комиссией Математических и общих естественнонаучных дисциплин, профессиональных дисциплин специальности Садово-парковое и ландшафтное строительство, Протокол № 12 от 16 мая 2018 г. Председатель комиссии ______________Черных Л.С. | «УТВЕРЖДАЮ» Зам. директора по УР «____» ____________2018 г. ____________ Литвинова Е.Н. |
Специальность 35.02.12 Садово-парковое и ландшафтное строительство
Курс 1 Семестр 2Группа 611
ОУДп.13 Химия
Билет № 22
Задание № 1 (теоретическое)
Текст задания: Выполните тест. В каждом номере выберите одно правильное утверждение.
Вариант 2.
1. Сколько ионов образуется при диссоциации двух молекул FeCI3?
1) 4
2) 10
3) 8
4) 5
2. Какие частицы являются анионами?
1) Fe3+
2) 
3) 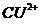
4) Mn2+
3. Какие электролиты являются сильными?
1) HI
2) KOH
3) H2S
4) H3PO4
4. Какова среда раствора, если рН < 7?
1) нейтральная
2) кислая
3) щелочная
5. Какие из следующих солей не подвергаются гидролизу?
1) PbNO3
2) KNO3
3) AI2(SO4)3
4) Pb2CO3
6. С какими из следующих веществ может реагировать оксид азота (V)?
1) CaCI2
2) H2O
3) H2SO4
4) HCI
7. Химическое понятие «моль» показывает:
1) число атомов вещества
2) число молекул вещества
3) количество вещества
4) молекулярную массу вещества
8. Фтор – это самый:
1) активный неметалл
2) прочный элемент
3) сильный окислитель
4) электроотрицательный элемент
9. У химических элементов главных подгрупп с увеличением атомного номера усиливаются:
1) металлические свойства
2) неметаллические свойства
3) химическая активность
4) растворимость в воде
10. Мельчащей химически неделимой частицей вещества является:
1) молекула
2) ион
3) атом
4) химический элемент
Условия выполнения заданий:
Место проведения: учебный кабинет
Время выполнения задания 20 мин.