Хлориды являются составной частью большинства природных вод. Содержание хлоридов естественного происхождения имеет большой диапазон колебаний. Однако в воде рек концентрация хлоридов невелика – она не превышает обычно 10–30 мг/л, поэтому повышенное содержание хлорид-ионов указывает на загрязнение источника сточными водами. В воде источников централизованного водоснабжения концентрация хлорид-ионов не должна превышать 350 мг/л.
В речных водах и водах пресных озер содержание хлоридов колеблется от долей миллиграмма до десятков, сотен, а иногда и тысяч миллиграммов на литр. В морских и подземных водах содержание хлоридов значительно выше – вплоть до пересыщенных растворов и рассолов.
Хлориды являются преобладающим анионом в высокоминерализованных водах. Концентрация хлоридов в поверхностных водах подвержена заметным сезонным колебаниям, коррелирующим с изменением общей минерализации воды.
Первичными источниками хлоридов являются магматические породы, в состав которых входят хлорсодержащие минералы (содалит, хлорапатит и др.), соленосные отложения, в основном галит. Значительные количества хлоридов поступают в воду в результате обмена с океаном через атмосферу, взаимодействия атмосферных осадков с почвами, особенно засоленными, а также при вулканических выбросах. Возрастающее значение приобретают промышленные и хозяйственно-бытовые сточные воды.
В отличие от сульфатных и карбонатных ионов, хлориды не склонны к образованию ассоциированных ионных пар. Из всех анионов хлориды обладают наибольшей миграционной способностью, что объясняется их хорошей растворимостью, слабо выраженной способностью к сорбции на взвесях и потреблением водными организмами. Повышенные содержания хлоридов ухудшают вкусовые качества воды и делают ее малопригодной для питьевого водоснабжения и ограничивают применение для многих технических и хозяйственных целей, а также для орошения сельскохозяйственных угодий. Если в питьевой воде есть ионы натрия, то концентрация хлорида выше 250 мг/дм3 придает воде соленый вкус. Концентрации хлоридов и их колебания, в том числе суточные, могут служить одним из критериев загрязненности водоема хозяйственно-бытовыми стоками.
Нет данных о том, что невысокие концентрации хлоридов оказывают вредное влияние на человека. ПДКв составляет 350 мг/дм3, ПДКвр – 300 мг/дм3.
Лимитирование верхнего предела концентрации хлоридов обусловлено тем, что более высокие концентрации этих ионов придают воде солноватый вкус и могут вызывать нарушение в работе желудочно-кишечного тракта у людей. При некоторых соотношениях сульфатов и хлоридов вода становится агрессивной по отношению к различным типам бетона.
Существует несколько способов определения концентрации хлорид- ионов в воде. Наиболее распространенными являются меркуриметрический и фотометрические методы. Второй способ является наиболее точным.
Приборы, посуда, реактивы: фотоэлектрокалориметр или нефелометр; кюветы; пипетки; бюретки; капельницы для индикаторов; конические колбы; смешанный индикатор (0,05 г дифенилкарбозона и 0,05 г бромфенолового синего растворяют в 100 мл этилового спирта); 0,2 н. раствор HNO3; 0.05 н. раствор Hg(NO3)2; нитрат серебра 0,005 н. раствор; 0,1 М раствор азотной кислоты; 50%-ный раствор этилового спирта; стандартный раствор хлорида калия (0,1015 г хлорида калия растворяют в дистиллированной воде, доводя объем до 500 мл),
Порядок выполнения работы и обработка результатов
Метод А
(меркуриметрический метод)
1. 100 мл исследуемой воды отбирают пипеткой в коническую колбу и добавляют 5 капель смешанного индикатора. Для достижения pH=2,5 прибавляют по каплям 0,2 н. раствор HNO3 до перехода окраски из синей в желтую, затем прибавляют еще 1 мл кислоты.
2. Титрование проводят 0,05 н. раствором Hg(NO3)2 до перехода окраски индикатора из желтой в фиолетовую. Расчет концентрации хлорид-ионов проводят по формуле:
X=V1NЭ1000/V2 (7.12)
где V 1 – объем нитрата ртути (II), пошедшего на титрование пробы, мл; N – нормальность раствора нитрата ртути (II), экв/л; Э – молярная масса эквивалента хлора (35,5), г/моль; V 2 – объем анализируемой пробы, мл.
Метод Б
(фотометрический метод)
1. Для построения калибровочного графика в 5 мерных колб на 50 мл последовательно вводят 1,0; 2,5; 5,0; 7,5; 10,0 мл стандартного раствора хлорида калия. В каждую колбу добавляют 20 мл раствора этанола, 10 мл азотной кислоты и 10 мл раствора нитрата серебра. Растворы перемешивают и помещают на 30 мин в водяную баню, нагретую до 40о С. Затем колбы охлаждают до температуры 20о С, растворы разбавляют дистиллированной водой до метки и перемешивают. Получают серию суспензий, содержащих соответственно 0,1; 0,25; 0,5; 0,75; 1.0 мг хлорид-ионов. Растворы поочередно помещают в кювету и записывают значения оптической плотности растворов. В качестве раствора сравнения используется анализируемая вода без добавления реактивов. По полученным данным строят калибровочный график.
6. В мерную колбу на 50 мл помещают 5–10 мл анализируемой сточной воды, добавляют 20 мл раствора этанола, 10 мл азотной кислоты и 10 мл раствора нитрата серебра, перемешивают и нагревают на водяной бане в течение 30 мин при 40о С. Затем раствор охлаждают и добавляют дистиллированную воду до метки. Суспензию помещают в кювету и записывают показания прибора. По калибровочному графику находят содержание хлорид-ионов во взятом объеме анализируемой пробы.
Метод В
(аргентометрический метод)
1. В пробу воды объемом 100мл добавить 10 капель 5 %-ного раствора хромовокислого калия.
2. Титрование проводят раствором нитрата серебра до устойчивой бурой окраски.
3. Содержание ионов хлора в пробе воды составит х, мг/л
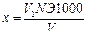
где V 1 – объем нитрата серебра, пошедшего на титрование пробы, мл; N – нормальность раствора нитрата серебра, экв/л; Э – молярная масса эквивалента хлора (35,5 г/моль); V 2 – объем анализируемой пробы, мл.