Элементарные стадии с участием координационных и металлоорганических соединений в растворах и на поверхности металлов и оксидов
Элементарные стадии органических реакций, катализируемых кислотами, основаниями, нуклеофильными катализаторами, комплексами металлов, твердыми металлами и их соединениями в газофазных или жидкофазных гетерогенных и гомогенных процессах, – это реакции образования и превращения различных органических и металлоорганических интермедиатов, а также комплексов металлов. К органическим промежуточным соединениям относятся ионы карбения R+, карбония RH2+, карбо-анионы R–, анион- и катионрадикалы  ,
,  , радикалы и бирадикалы R·, R:, а также молекулярные комплексы органических донорных и акцепторных молекул (D ® A), которые называют также комплексами с переносом заряда. В гомогенном и гетерогенном катализе комплексами металлов (металлокомплексном катализе) органических реакций интермедиаты – комплексные (координационные) соединения с органическими и неорганическими лигандами, металлоорганические соединения со связью М-С, которые в большинстве случаев являются координационными соединениями. Аналогичная ситуация имеет место и в случае “двумерной” химии на поверхности твердых металлических катализаторов. Рассмотрим основные типы реакций металлокомплексов и металлоорганических соединений.
, радикалы и бирадикалы R·, R:, а также молекулярные комплексы органических донорных и акцепторных молекул (D ® A), которые называют также комплексами с переносом заряда. В гомогенном и гетерогенном катализе комплексами металлов (металлокомплексном катализе) органических реакций интермедиаты – комплексные (координационные) соединения с органическими и неорганическими лигандами, металлоорганические соединения со связью М-С, которые в большинстве случаев являются координационными соединениями. Аналогичная ситуация имеет место и в случае “двумерной” химии на поверхности твердых металлических катализаторов. Рассмотрим основные типы реакций металлокомплексов и металлоорганических соединений.
Элементарные стадии с участием комплексов металлов
Реакции металлокомплексов можно разделить на три группы:
а) реакции переноса электрона;
б) реакции замещения лигандов;
в) реакции координированных лигандов.
Реакции переноса электронов
Два механизма реализуются в реакциях переноса электронов – внешнесферный механизм (без изменений в координационных сферах донора и акцептора) и мостиковый (внутрисферный) механизм, приводящий к изменениям в координационной сфере металла.
Рассмотрим внешнесферный механизм на примере октаэдрических комплексов переходных металлов. В случае симметричных реакций (D G 0 = 0)

константы скорости меняются в очень широком интервале значений – от 10–12 до 105 л·моль–1·сек–1, в зависимости от электронной конфигурации иона и степени ее перестройки в ходе процесса. В этих реакциях очень наглядно проявляется принцип наименьшего движения – наименьшего изменения валентной оболочки участников реакции.
В реакции переноса электрона (1) (Со* – изотоп атома Со)
 (1)
(1)
 (симметричная реакция), Co2+ (d7) переходит в Co3+ (d6). Электронная конфигурация (валентная оболочка) в ходе этого переноса не меняется
(симметричная реакция), Co2+ (d7) переходит в Co3+ (d6). Электронная конфигурация (валентная оболочка) в ходе этого переноса не меняется

6 электронов на трижды вырожденном связывающем уровне остаются без изменения (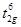 ), а с разрыхляющего eg уровня снимается один электрон. Константа скорости второго порядка для реакции (1) k 1 = 1.1 л×моль–1×сек–1. Поскольку Phen (фенантролин) относится к сильным лигандам, максимальное число из 7 d -электронов спарено (спин-спаренное состояние). В случае слабого лиганда NH3 ситуация кардинально меняется. Co(NH3)n2+ (n = 4, 5, 6) находится в спин-неспаренном (высокоспиновом) состоянии
), а с разрыхляющего eg уровня снимается один электрон. Константа скорости второго порядка для реакции (1) k 1 = 1.1 л×моль–1×сек–1. Поскольку Phen (фенантролин) относится к сильным лигандам, максимальное число из 7 d -электронов спарено (спин-спаренное состояние). В случае слабого лиганда NH3 ситуация кардинально меняется. Co(NH3)n2+ (n = 4, 5, 6) находится в спин-неспаренном (высокоспиновом) состоянии  .
.
Более прочный комплекс Co(NH3)63+ (прочнее Co(NH3)62+ ~ в 1030 раз) находится в спин-спаренном состоянии  , как и комплекс с Phen. Поэтому в процессе переноса электрона
, как и комплекс с Phen. Поэтому в процессе переноса электрона  должна сильно перестроиться валентная оболочка и в результате k = 10–9 л×моль–1×сек–1. Степень превращения Со2+ в Со3+, равная 50%, достигается в случае лиганда Phen за 1 секунду, а в случае NH3 ~ за 30 лет. Очевидно, что стадию с такой скоростью (формально элементарную) можно исключить из набора элементарных стадий при анализе механизмов реакции.
должна сильно перестроиться валентная оболочка и в результате k = 10–9 л×моль–1×сек–1. Степень превращения Со2+ в Со3+, равная 50%, достигается в случае лиганда Phen за 1 секунду, а в случае NH3 ~ за 30 лет. Очевидно, что стадию с такой скоростью (формально элементарную) можно исключить из набора элементарных стадий при анализе механизмов реакции.
Величина D G ¹ для реакции переноса электронов при образовании комплекса столкновения согласно теории Маркуса включает два компонента  и
и 
 (2)
(2)
Первый член – энергия реорганизации связей M-L внутри комплекса (длина и прочность связи при изменении валентного состояния). Величина  включает энергию перестройки внешней сольватной оболочки в процессе изменения координат M-L и заряда комплекса. Чем меньше изменение электронного окружения и меньше изменение длины M-L, тем ниже
включает энергию перестройки внешней сольватной оболочки в процессе изменения координат M-L и заряда комплекса. Чем меньше изменение электронного окружения и меньше изменение длины M-L, тем ниже  , чем больше по размерам лиганды, тем меньше
, чем больше по размерам лиганды, тем меньше  и, в результате, выше скорость переноса электронов. Величину
и, в результате, выше скорость переноса электронов. Величину  для общего случая можно рассчитать по уравнению Маркуса
для общего случая можно рассчитать по уравнению Маркуса
 , (3)
, (3)
где  . При
. При  = 0
= 0  .
.
В случае внутрисферного механизма процесс переноса электрона облегчается, поскольку один из лигандов первого комплекса образует мостиковый комплекс со вторым комплексом, вытесняя из него один из лигандов


Константы скорости такого процесса на 8 порядков выше константы для восстановления Cr(NH3)63+. В таких реакциях восстанавливающий агент должен быть лабильным комплексом, а лиганд в окислителе должен быть способен к образованию мостиков (Cl–, Br–, I–, N3–, NCS–, bipy).