Реакции ионного обмена, гидролиз солей. Понятие о степени и константе гидролиза. Окислительно-восстановительные реакции, их классификация. Практическое применение реакций окисления-восстановления.
Окислительно-восстановительные реакции
Окислительно-восстановительными называются реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ. Так, например, реакции:
2Hg+2O-2= 2Hg0 +  ,
,
2K+1I-1 + 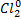 = 2K+1CL-1 +
= 2K+1CL-1 + 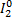
являются окислительно-восстановительными. Как обозначено в уравнениях, в первой реакции ртуть и кислород, а во второй йод и хлор изменяют степень окисления.
С современной точки зрения изменение степени окисления связано с переходом электронов. Поэтому наряду с приведенным можно дать и такое определение окислительно-восстановительных реакций: это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Часто определяют окислительно-восстановительные реакции как реакции, которые протекают с изменением валентности реагирующих атомов. Но это не является общим определением. Известны окислительно-восстановительные реакции, при протекании которых величины валентности реагирующих элементов не изменяются, а происходит лишь перераспределение электронных связей. К таким реакциям можно отнести присоединение водорода к непредельным углеводородам – ацетилену, этилену и другим.
Перераспределение электронных связей происходит при взаимодействии водорода с хлором с образованием полярного соединения HCl.
Таким образом, распространять положение об изменении величины валентности реагирующих атомов на все окислительно-восстановительные реакции нельзя. Выход из этого положения – использование условного представления о степени окисления атомов. Это позволило применить идею о переносе электронов ко многим органическим веществам.
Теперь рассмотрим основные положения, относящиеся к теории окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом. Например:
Al- 3e = Al3+,
H2 – 2e = 2H+,
Fe2+- e = Fe3+,
2Cl- - 2e = Cl2.
При окислении степень окисления повышается.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Например:
S + 2e=S2-,
Cl2 + 2e = 2Cl-,
Fe3+ +e= Fe2+.
При восстановлении степень окисления понижается.
Существует несколько способов составления уравнений окислительно-восстановительных реакций. Мы воспользуемся методом электронного баланса. Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. В основе его лежит правило, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Сущность этого метода можно проследить на примере составления уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Сначала пишем схему реакции – взятые и полученные вещества:
H2S + KMnO4 + H2SO4 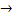 S + MnSO4 + K2SO4 + H2O.
S + MnSO4 + K2SO4 + H2O.
Затем определяем изменение степеней окисления атомов до и после реакции:
H2S-2 + KMn+7O4+ H2SO4 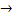 S0 + Mn+2SO4 + K2SO4 +H2O.
S0 + Mn+2SO4 + K2SO4 +H2O.
Отсюда видно, что изменяются степени окисления у серы и марганца (H2S – восстановитель, KMnO4 – окислитель).
Далее составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
S-2 – 2e = So 5
Mn+7 +5e = Mn+2 2.
И наконец находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 молекул H2S и 2 молекулы KMnO4, тогда получим 5 атомов S и 2 молекулы MnSO4. Кроме того, из сопоставления атомов в левой и правой частях уравнения найдем, что образуется также 1 молекула K2SO4 и 8 молекул воды.
Окончательное уравнение реакции будет иметь вид
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O.
Или в иной форме
5H2S + 2MnO4- + 6H+ = 5S+2Mn+2 + 8H2O.
Правильность написания уравнения проверяется путем подсчета атомов каждого элемента в левой и правой частях уравнения.
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.