Агрегатные состояния вещества. Понятие о растворах. Свойства растворов. Способы выражения концентрации растворов. Решение задач. Свойства растворов неэлектролитов. Электролитическая диссоциация. Свойства растворов электролитов, изотонический коэффициент.
Понятие о растворах
Растворами обычно называют устойчивые жидкие или твердые гомогенные дисперсные системы, состоящие из двух или более компонентов, относительные количества которых могут изменяться в широких пределах. Среди компонентов, составляющих раствор, различают растворитель (среда) и растворенное вещество (фаза).
Растворителем считается компонент, который сохраняет свое агрегатное состояние при образовании раствора и содержание которого в растворе может быть не меньше вполне определенной величины. Растворенное вещество может изменять свое агрегатное состояние при образовании раствора, а содержание его в растворе не может превышать его растворимости.
Мерой растворимости вещества является число граммов вещества, которое при данной температуре может раствориться в 100 г растворителя. Это число называется коэффициентом растворимости, или растворимостью вещества.
Растворы занимают промежуточное положение между химическим соединением и механической смесью.
Эквивалентные соотношения между растворенным веществом и растворителем при растворении не соблюдается. Например, объем раствора не равен сумме объемов растворенного вещества и растворителя, т.е. растворы можно рассматривать как механические смеси. По некоторым признакам они близки к химическим соединениям. В частности, при растворении всегда поглощается или выделяется энергия. Например, при растворении азотнокислого аммония происходит сильное охлаждение, а при растворении гидрооксида калия – сильное разогревание жидкости.
Исследование растворов различными методами позволило установить наличие во многих из них так называемых сольватов (в частном случае водных растворов – гидратов), представляющих собой более или менее непрочные соединения частиц растворенного вещества с молекулами растворителя.
Процесс растворения – это физико-химический процесс. Образование сольватов иногда настолько изменяет свойства растворенного вещества, что может быть обнаружено прямым наблюдением. Например, безводный сульфат меди бесцветен, тогда как водный раствор имеет голубую окраску.
Так как из всех обычных растворителей наиболее полярными молекулами обладает вода, чаще всего приходится иметь дело с гидратами. Гидратная вода иногда настолько прочно связана с растворенным веществом, что при выделении вещества из раствора входит в состав его кристаллов. Такие кристаллические образования называются кристаллогидратами. Например: CuSO4×5H2O – медной купорос.
Процесс растворения – это самопроизвольное распределение одного вещества в другом в результате диффузии. Количественным выражением способности вещества растворяться в растворителе (например, в воде) при данных условиях является концентрация его насыщенного раствора.
Насыщенным при данной температуре называется такой раствор, в котором имеет место равновесное состояние системы «раствор = растворенное вещество», т.е. когда скорость растворения вещества становится равной скорости его кристаллизации из раствора. Таким образом, насыщенный раствор – это термодинамически неустойчивая система.
Ненасыщенный раствор содержит меньшее количество растворенного вещества (меньше его растворимости при данной температуре). Перенасыщенный раствор содержит растворенное вещество в количестве большем его растворимости при данной температуре.
Изменением растворимости с температурой часто пользуются для очистки веществ перекристаллизацией. Например, при остывании горячего насыщенного раствора значительная часть растворенного вещества выделяется в осадок, а примеси остаются в растворе. Практически также пользуются такими обозначениями, как разбавленный раствор и концентрированный раствор.
Способы выражения концентрации растворов
Концентрация растворов определяется количеством растворенного вещества, содержащегося в единице объема или массы раствора или растворителя.
Употребляются следующие выражения концентрации растворов:
1. Массовая доля (С%), или процентная концентрация, выражается числом граммов растворенного вещества в 100 г раствора. Концентрация газовых и жидких смесей выражают также в процентах по объему.
2. Молярная (М) концентрация выражается количеством грамм-молей растворенного вещества в 1 дм3 раствора.
3. Нормальная (Н), или эквивалентная концентрация выражается числом грамм-эквивалентов растворенного вещества в 1 дм3 раствора.
4. Моляльная концентрация (m) выражается числом грамм-молей растворенного вещества в 1000 г растворителя.
5. Титр раствора (Т) выражается количеством граммов растворенного вещества в 1 см3 раствора.
6. Мольная доля растворенного вещества (NI) выражается отношением количества моль растворенного вещества к общему количеству моль всего раствора:
NI=  ,
,
где 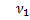 - моль растворенного вещества;
- моль растворенного вещества;
 - моль растворителя.
- моль растворителя.
Мольная доля растворителя
NII=  ,
,
Расчет концентрации растворов
Пример 1. Сколько граммов технической соды Na2CO3×10H2O надо взять для приготовления 200 см3 0,1 н. раствора?
Решение:
Молярная масса Na2CO3×10H2O = 286 г/моль. Эквивалентная масса соли:
286:2 = 143 г.
1 Э = 143г – 1дм3 – 1н,
0,1 Э = 14,3г – 1дм3 – 0,1н.
Следовательно, для приготовления 200 см3 раствора надо взять
1000см3 – 14,3 г
200см3 – Х г
Х =  = 2,86 г Na2CO3×10H2O.
= 2,86 г Na2CO3×10H2O.
Для приготовления такого раствора надо растворить 2,86 г соды в мерной колбе на 200 см3 в небольшом количестве воды и довести уровень до метки дистиллированной водой.
Пример 2. Определить молярность и нормальность 20% раствора серной кислоты ( = 1,143 г/см3).
= 1,143 г/см3).
Решение:
Сначала надо найти содержание H2SO4 в 1 дм3 раствора. Для этого определяем массу 1 дм3, исходя из плотности:
 ,
,
m=  V = 1,143 г/см3 × 1000 см3 = 1143 г.
V = 1,143 г/см3 × 1000 см3 = 1143 г.
Следовательно,
20 г H2SO4 – 100 г раствора
Х г – 1143 г раствора
Х =  = 228,6 (г) H2SO4.
= 228,6 (г) H2SO4.
Зная, что молярная масса  = 98 г/моль, можно определить молярность раствора
= 98 г/моль, можно определить молярность раствора
98 г – 1 М
228,6 г – х М
х =  = 2,33 М.
= 2,33 М.
Эквивалент серной кислоты определяем по формуле
Э =  =
=  = 49 г.
= 49 г.
Можно определить нормальность
49 г – 1 н х =  = 4,66 Н
= 4,66 Н
228,6 г – х н
Пример 3. Из 40 % раствора и воды приготовить 10% раствор
Решение
40 10 (раствор)
О 30 (H2O)
На 10 весовых частей (в.ч.) раствора надо взять 30 в.ч. воды.