Методы качественного анализа. Свойства металлов, качественные реакции. Классификация методов количественного анализа. Теоретические основы химических методов анализа. Методы титриметрического анализа. Титрование, титр раствора. Физико-химические методы анализа. Классификации методов. Рефрактометрический метод анализа.
Титриметрический анализ (метод нейтрализации)
В титриметрическом анализе основной операцией является измерение объема двух взаимодействующих растворов, один из которых содержит анализируемое вещество, а концентрация второго заранее известна. Концентрацию анализируемого раствора определяют, зная соотношение объемов реагирующих растворов и концентрацию стандартного раствора:
 =
=  .
.
Применяемые для титрования растворы с точной, заранее установленной концентрацией называют стандартными, рабочими или титрованными растворами. Концентрацию рабочего раствора выражают через его нормальность, молярность или титр.
Титрование – определение объемов двух растворов, в которых содержится эквивалентное количество взаимодействующих веществ. При титровании устанавливают момент окончания реакции, т.е. момент, когда в добавленном объеме стандартного раствора содержится количество вещества, эквивалентное количеству определяемого вещества. Этот момент называют моментом эквивалентности, или точкой эквивалентности. Титром Т раствора называют количество граммов растворенного вещества, содержащееся в 1 см3 раствора.
Зная нормальность раствора, можно вычислить его титр по формуле
Т = 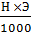 .
.
Титр стандартного раствора можно выразить в граммах анализируемого вещества, т.е. определить, какому весовому количеству анализируемого вещества соответствует 1 см3 рабочего раствора:
Т = 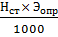 .
.
Например, вычислить титр 0,1 н. раствора H2SO4 по NaOH. Если ЭNaOH = 40 г, НН2SO4 = 0,1, тогда
Т = 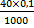 = 0,004 (г/см3).
= 0,004 (г/см3).
Основной реакцией в методе нейтрализации служит реакция взаимодействия кислоты с основанием: Н+ + ОН-= Н2О. Этот метод применяется главным образом для количественного определения кислот и щелочей. В качестве стандартных растворов используют растворы сильных электролитов кислот и щелочей. Точка эквивалентности в методе нейтрализации устанавливается индикаторным методом. В качестве индикаторов используют вещества, меняющие свою окраску в зависимости от концентрации ионов водорода в растворе. Индикаторы характеризуются интервалом перехода окраски. Он определяется значением pH раствора, в пределах которого данный индикатор меняет свою окраску. Важной характеристикой индикатора при нейтрализации является показатель титрования pT. Показателем титрования называется та концентрация ионов водорода, при которой наиболее резко изменяется окраска индикатора (рис. 2).
метиловый-оранжевый 8 9 10 11 12 13 14 15
0 1 2 3 4 5 6 7 фенолфталеин
Рис. 2. Шкала pH
Рефрактометрический метод анализа
Рефракция – явление преломления света на границе двух сред, различных по оптической плотности. Рефрактометрия – измерение преломления света. Количественно рефракцию оценивают по углу преломления или показателю преломления света. Рефрактометрический метод анализа основан на зависимости показателя преломления от концентрации раствора, состава вещества. Преломление света обусловлено изменением скорости света в среде (рис. 3).
Абсолютным показателем преломления N называют отношение скорости света в вакууме VMAX к скорости при N>1.
Рис. 3. Рефракция света
Относительным показателем преломления света называют отношение синуса угла падения к синусу угла преломления света:
n=  .
.
Определение показателя преломления вещества сводится к измерению предельного угла преломления на границе жидкость - стекло (рис. 4).
Рис. 4. Преломление света на границе раздела двух сред
Когда > 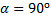 , луч скользит вдоль границы раздела, т.е. не преломляется. Если,<
, луч скользит вдоль границы раздела, т.е. не преломляется. Если,<  чуть меньше 90о, то луч света претерпевает преломление и при этом получается предельный <
чуть меньше 90о, то луч света претерпевает преломление и при этом получается предельный < 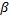 (положение б на рис. 4, видна граница света и тени).
(положение б на рис. 4, видна граница света и тени).
Если 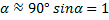 , тогда
, тогда
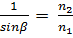 ,
,
n1=n2 ×sin 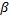 ,
,
где n1- показатель преломления исследуемой среды;
n2 - показатель преломления призмы.
Величина показателя преломления зависит от природы вещества, длины волны света, температуры. С увеличением температуры показатель преломления уменьшается, поэтому для определения n1 при постоянной температуре (20  рефрактометры снабжены устройством для термостатирования призменного блока.
рефрактометры снабжены устройством для термостатирования призменного блока.
Зависимость показателя преломления от длины волны падающего света называют дисперсией. Значение показателя преломления определяют относительно желтой линии (линия D) в спектре  = 589 нм. В соответствии со стандартными значениями условий измерения показатели преломления обозначают
= 589 нм. В соответствии со стандартными значениями условий измерения показатели преломления обозначают 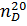 (для каждого вещества своя величина).
(для каждого вещества своя величина).
Аппаратура для рефрактометрических измерений
Приборы, применяемые для измерения предельного угла преломления света 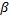 , называются рефрактометрами. В основу устройства рефрактометров типа Аббе заложена принципиальная схема измерения предельного угла преломления, или показателя преломления (рис. 5). В рефрактометре менее оптически плотной средой является анализируемая жидкость, более оптически плотной – стеклянная призма прибора.
, называются рефрактометрами. В основу устройства рефрактометров типа Аббе заложена принципиальная схема измерения предельного угла преломления, или показателя преломления (рис. 5). В рефрактометре менее оптически плотной средой является анализируемая жидкость, более оптически плотной – стеклянная призма прибора.
Рис. 5. Принципиальная схема рефрактометра Аббе:
1 – осветительная призма; 2 – слой жидкости; 3 – измерительная призма;
4 – предельный луч; 5 – призма Амичи; 6 – зрительная труба; 7 – видимое поле
Основным узлом оптической схемы рефрактометра является призменный блок 2 (рис. 6), состоящий из подвижной части – осветительной призмы и неподвижной – измерительной призмы. Основные узлы прибора вмонтированы в металлический корпус.
Рис. 6. Общий вид рефрактометра ИРФ-454:
1, 12 – направляющие; 2 – измерительный блок; 3, 7, 9, 11 – штуцера;
4 – шкала дисперсии; 5 – нониус; 6 – окуляр; 8 – рукоятка осветительной призмы;
10 – зеркало для подвески шкалы показателей преломления;
13 – юстировочный ключ; 14 – зеркало для подвески осветительной
призмы; 15 – маховик зрительной трубы
Для получения четкой границы на пути лучей, входящих в зрительную трубку, установлен дисперсионный компенсатор, который по конструкции представляет призму Амичи (рис. 7). Призма Амичи склеена из трех призм: двух крайних - из крона и средней - из флинта. Крон – это стекло с добавлением свинцовой соли хромовой кислоты, флинт – стекло, содержащее свинец. Все три призмы подобраны с таким расчетом, чтобы желтые лучи D проходили через всю систему призм, не изменяя своего первоначального направления. На корпус выведены направляющие 1, 12 типа «ласточкин хвост» для установки призменных блоков (сменных) (рис. 6).
Рис. 7. Призма Амичи
Перед началом работы прибор термостатируют и юстируют. Для термостатирования призм и анализируемого образца соединяют призменный блок 2 с циркуляционным термостатом, для этого в оправах призм имеются штуцеры 3, 7, 9, 11. Температура контролируется с помощью термометра, закрепленного в рефрактометре. Юстировку проводят по дистиллированной воде. Для этого в измерительную призму помещают несколько капель дистиллированной воды и измеряют показатель преломления 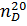 . Он должен быть равен 1,333. Если показание отличается от табличного, то поворотом маховика 15 выставляют на шкале значение 1,333. Границу света и тени устанавливают в перекрестье с помощью юстировочного ключа 13. С помощью маховика 4 дисперсионного компенсатора добиваются исчезновения окраски пограничной линии. Граница света и тени должна быть четкой.
. Он должен быть равен 1,333. Если показание отличается от табличного, то поворотом маховика 15 выставляют на шкале значение 1,333. Границу света и тени устанавливают в перекрестье с помощью юстировочного ключа 13. С помощью маховика 4 дисперсионного компенсатора добиваются исчезновения окраски пограничной линии. Граница света и тени должна быть четкой.
Перед измерением  анализируемой жидкости рабочие грани призм тщательно протирают спиртом, затем с помощью стеклянной палочки на поверхность измерительной призмы наносят 2-3 капли анализируемой жидкости. Осветительную призму 8 опускают и прижимают крючком. Поворотом зеркала 10 добиваются наилучшей освещенности шкалы и видимости зрительного поля. Вращением маховика 1 выводят границу светотени в поле зрения. Вместе с маховиком 4 вращается шкала угловой дисперсии с нониусом 5. Шкала 4 разделена на 120 делений. Поворот маховика на одно деление шкалы соответствует повороту призмы Амичи на 3о. Десятые доли шкалы определяются по нониусу 5. Одно деление нониуса соответствует повороту призмы Амичи на 0,3о.
анализируемой жидкости рабочие грани призм тщательно протирают спиртом, затем с помощью стеклянной палочки на поверхность измерительной призмы наносят 2-3 капли анализируемой жидкости. Осветительную призму 8 опускают и прижимают крючком. Поворотом зеркала 10 добиваются наилучшей освещенности шкалы и видимости зрительного поля. Вращением маховика 1 выводят границу светотени в поле зрения. Вместе с маховиком 4 вращается шкала угловой дисперсии с нониусом 5. Шкала 4 разделена на 120 делений. Поворот маховика на одно деление шкалы соответствует повороту призмы Амичи на 3о. Десятые доли шкалы определяются по нониусу 5. Одно деление нониуса соответствует повороту призмы Амичи на 0,3о.
КОНТРОЛЬНЫЕ ВОПРОСЫ
ДЛЯ ПОДГОТОВКИ К ЗАЧЕТУ
I. Основные законы химии
1. Закон постоянства состава.
2. Закон сохранения массы веществ.
3. Закон эквивалентов, решение задач.
4. Определение химических эквивалентов простых веществ.
5. Определение химических эквивалентов сложных веществ.
6. Закон Авогадро.
7. Следствия закона Авогадро, решение задач.
II. Химическая кинетика
8. Понятие о средней скорости химической реакции.
9. Применение закона действия масс.
10. Влияние концентрации на скорость химической реакции.
11. Закон действия масс для скорости химической реакции, решение задач.
12. Влияние температуры на скорость химической реакции.
13. Катализаторы и их влияние на скорость химической реакции.
14. Понятие о химическом равновесии.
15. Вывод константы химического равновесия.
16. Принцип Ле Шателье, смещение химического равновесия.
III. Свойства растворов
17. Понятие о растворах.
18. Классификация растворов.
19. Способы выражения концентрации растворов, решение задач.
20. Физико-химические свойства растворов неэлектролитов.
21. Законы Рауля и Вант-Гоффа.
22. Физико-химические свойства растворов электролитов.
23. Теория электролитической диссоциации.
24. Сильные и слабые электролиты.
25. Изотонический коэффициент для законов Рауля и Вант-Гоффа.
СПИСОК ЛИТЕРАТУРЫ
И ИНТЕРНЕТ-РЕСУРСОВ
Основные источники
1. Коровин В.Н. Общая химия, 11-е изд. М.: Высшая школа, 2009.
2. Юрьева А.В. Физико-химические методы анализа. М.: Высшая школа, 2005.
3. Васильев В.П. Аналитическая химия. Учебник для вузов. М.: Дрофа, 2007.
Дополнительные источники
4. Мухина Е.А. Физико-химические методы анализа. М.: Химия, 1995.
5. Шапиро С.А., Шапиро М.А. Аналитическая химия. М.: Высшая школа, 2003.
Интернет-ресурсы
1. www.msgra.ru
2. www.twirpx.ru
3. www.knigafund.ru