ХИМИЯ
Методические указания
по изучению курса
Егорьевск 2013
УДК 54
ББК 24.1+74.262.4
Б 95
Рекомендуется редсоветом ЕАТК им. В.П.Чкалова – филиала МГТУ ГА
в качестве методических указаний
для учащихся спец. 162105.51
Рецензент к.х.н. Н.В.Белов
Е.И.Бычкина
Б 95 Химия. Методические указания по изучению курса. - Егорьевск: ЕАТК им. В.П.Чкалова – филиал МГТУ ГА, 2013. - 20 с.
Предназначены для учащихся спец. 162105.51 заочного отделения.
Елена Ивановна Бычкина
ХИМИЯ
Методические указания
по изучению курса
Зав. РИО Л.Н.Семенова
Подписано в печать 11.06.2013
Ризография
Формат 60х84 1/16. Усл.печ.л. 1,16. Уч.-изд.л. 1,54
Тираж 50 экз. Заказ 25-1-13
ЕАТК им. В.П.Чкалова – филиал МГТУ ГА
Владимирская, 2, Егорьевск, М.О., 140305
ã Егорьевский авиационный технический колледж им. В.П.Чкалова – филиал МГТУ ГА, 2013
ã Е.И.Бычкина, 2013
ВВЕДЕНИЕ
Химия - одна из фундаментальных естественных наук, изучающая законы окружающего мира. В настоящее время без развития химической науки невозможно осуществлять научно-технический прогресс в организациях по эксплуатации и ремонту авиационной и наземной техники. Поэтому знание основных законов и разделов общей химии формирует у специалиста научно-технический кругозор, закладывает фундамент для изучения специальных дисциплин. Для изучения предмета необходимо знание физики, химии, математики в объеме средней школы.
Изучение данной дисциплины дает будущему специалисту теоретическую подготовку по основным разделам общей химии, на основании которых он должен уметь практически применять знания при решении задач, связанных с улучшением качества технического обслуживания авиатехники, условий хранения, транспортирования и применения топлив.
В результате изучения дисциплины учащиеся должны
знать:
- основные законы химии;
- химическую кинетику;
- способы выражения концентрации растворов;
уметь:
- применять основные законы химии;
- закон действующих масс для скорости химической реакции;
- решать задачи по определению концентрации растворов.
ПРОГРАММА И МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО ИЗУЧЕНИЮ ТЕМ
Раздел 1. Общая химия
Тема 1.1. Основные законы химии
Законы сохранения массы веществ, постоянства состава, закон эквивалентов, закон Авогадро, парциальных давлений Дальтона, Клайперона-Менделеева. Примеры решения задач с применением основных законов химии.
.
Определение эквивалента простых веществ
Химическим эквивалентом (или эквивалентной массой) элемента называется такое количество его, которое соединяется с 1,008 весовыми частями водорода или 8 весовыми частями кислорода, или замещает эти количества в соединениях. Количество элемента, численно равное эквиваленту и выраженное в граммах, называется грамм-эквивалентом. Понятие об эквиваленте имеет большое значение в химии, поскольку с его помощью формулируется один из основных законов химии - закон эквивалентов: химические элементы соединяются между собой в отношении их эквивалентных масс, или эквивалентов:
 =
=  .
.
Массы веществ, вступающих в реакцию, прямо пропорциональны их химическим эквивалентам. Например, 1,008 в.ч. водорода соединяются с 8 в.ч. кислорода или с 35,5 в.ч. хлора, или с 23 в.ч. натрия; 2,016 в.ч. водорода соединяются с 16 в.ч. кислорода или 71 в.ч. хлора, или 46 в.ч. натрия и т.д.
Между эквивалентом Э, атомной массой А и валентностью n элемента существует зависимость
Э =  . (1)
. (1)
По этой формуле определяется теоретическое знание эквивалента. Например:
ЭZn= 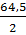 = 32,7 (г); ЭAI =
= 32,7 (г); ЭAI =  = 9 (г) и т.д.
= 9 (г) и т.д.
Часто элементы образуют друг с другом несколько соединений. В этом случае в разных соединениях один и тот же элемент будет иметь различные эквиваленты. Например, эквивалент одновалентной меди в соединении Cu2O ЭСu(I) =  = 64, а эквивалент двухвалентной меди в соединении CuO ЭCu(I) =
= 64, а эквивалент двухвалентной меди в соединении CuO ЭCu(I) =  = 32.
= 32.
Между различными эквивалентами одного и того же элемента существует зависимость, определяемая законом кратных отношений: если два элемента образуют между собой несколько соединений, то весовые количества одного элемента, соединяющиеся с одним и тем же весовым количеством другого элемента, относятся между собой как небольшие целые числа. В приведенном примере эквиваленты азота в различных соединениях азота относятся как 1:2:3:4:5. Закон эквивалентов и закон кратных отношений экспериментально подтвердили атомную теорию строения вещества.
Уравнение (1) позволяет вычислить атомную массу элемента, если известны его эквивалент и валентность:
А=Эn,
т.е. атомная масса элемента равна произведению его эквивалента на валентность.
Определение эквивалента сложного вещества
Понятие об эквивалентах применимо и к соединениям. Под эквивалентом соединения понимают такое весовое количество его, которое в данной реакции взаимодействует с одним эквивалентом водорода (1,008 в.ч.) или одним эквивалентом кислорода (8 в.ч.), или одним эквивалентом другого вещества. Исторически понятие об эквивалентах соединений (кислот и щелочей) было введено в химии раньше, чем понятие об эквивалентах элементов.
Как для элементов, так и для сложных веществ имеет место закон эквивалентов: вещества вступают в реакцию между собой в отношении их эквивалентных масс, или эквивалентов. Поэтому важно научиться вычислять эквиваленты сложных веществ. При вычислении эквивалентов соединений типа кислот, оснований и солей можно пользоваться следующими правилами.
Эквивалент кислоты Эк равен молярной массе кислоты Мк, деленной на ее основность n. Основность кислоты определяется числом атомов водорода в её молекуле, которые могут замещаться на металл. Значит,
ЭК = 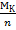 .
.
Пример: ЭH2SO4=  = 49 (г).
= 49 (г).
Эквивалент основания ЭО равен молярной массе основания МО, деленной на число групп ОН-в молекуле основания nOH или валентность металла, образующего оксид:
ЭО = 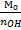 .
.
Пример: ЭCa(OH)2=  = 37 (г).
= 37 (г).
Эквивалент соли Эс равен молярной массе основания МС, деленной на произведение числа атомов металла a на валентность металла n, т.е.
Эс = 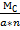 .
.
Пример: ЭAl2(SO)3 =  = 57 (г).
= 57 (г).
Следует всегда иметь в виду, что эквивалент сложного вещества определяется реакцией, в которой участвует вещество (по определению). Поэтому он не является постоянной величиной (как, например, молекулярная масса) и может иметь различные значения. Поясним это на примере взаимодействия фосфорной кислоты со щелочью:
а) H3PO4 + NaOH = NaH2PO4 + H2O.
В этой реакции молекула кислоты реагирует с молекулой воды NaOH, что соответствует одному эквиваленту водорода. Поэтому эквивалент кислоты равен ее молекулярной массе:
ЭH3PO4=  =
= 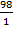 = 98 (г).
= 98 (г).
Грамм-эквивалент кислоты равен 98 г;
б) H3PO4 + 2 NaOH = Na2HPO4 + 2 H2O.
В данной реакции молекула кислоты соответствует двум эквивалентам водорода (или двум эквивалентам щелочи). Поэтому
ЭH3PO4= 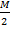 =
=  = 49 (г).
= 49 (г).
Грамм-эквивалент кислоты равен 49 г;
в) H3PO4 + 3 NaOH = Na3PO4 + 3 H2O.
В данной реакции
ЭH3PO4= 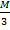 =
=  = 32,7 (г).
= 32,7 (г).
Грамм-эквивалент кислоты равен 32,7 г.
Таким образом, в трех реакциях фосфорная кислота имеет три различных значения эквивалента. Очевидно, что для нахождения величины эквивалента надо составить уравнение химической реакции, в которой участвует вещество, и с учетом уравнения реакции произвести вычисления.
Эквивалентами соединений пользуются для выражения концентрации растворов, часто применяемых в лабораторной практике. Раствор, в одном дм3 которого содержится один грамм-эквивалент растворенного вещества, называется нормальным. Если в 1 дм3 раствора содержится 0,1 г-экв, - миллинормальным.
Нормальность раствора – это число грамм- эквивалентов вещества, содержащегося в 1 дм3 раствора. Нормальность обычно обозначается буквой н. Например, 1 н. раствор H2SO4 1 дм3 такого раствора содержит 1 г-экв, т.е. 49 г. H2SO4;0,01 н. NaOH – сантинормальный раствор едкого натрия, 1 дм3 его содержит 0,01 г-экв, т.е. 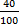 = 0,4 (г) NaOH и т.д.
= 0,4 (г) NaOH и т.д.
Зная нормальность раствора н. и эквивалент растворенного вещества Э, легко вычислить, сколько граммов вещества содержится в 1 см3 раствора. Для этого надо массу растворенного вещества разделить на 1000.
Количество растворенного вещества в граммах, содержащееся в 1 см3 раствора, называется титром раствора. Обычно принято титр обозначать буквой Т. Тогда
Т=  .
.
Пример: Т0,1НH2SO4=  = 0,0049 (г/см3).
= 0,0049 (г/см3).